Решение уравнений с учетом химических свойств металлов является важной задачей в химии. Металлы - это группа элементов, которые обладают определенными физическими и химическими свойствами. Они способны образовывать ионы положительного заряда и обладают высокой электропроводностью.
Для решения уравнений, в которых принимают участие металлы, необходимо учитывать их особенности. Металлы часто вступают в реакции окисления-восстановления, образуя ионы различных зарядов. При этом металлы способны передавать электроны другим атомам или ионам, что позволяет им претерпевать химические превращения.
В химическом уравнении с участием металлов необходимо правильно сбалансировать уравнение, чтобы количество атомов каждого элемента с обеих сторон равнялось. При этом необходимо учитывать заряд ионы металла и его валентность. Для решения данной задачи часто используются методы окислительно-восстановительного титрования и методы полуравновесных реакций.
Химические свойства металлов и их роль в решении уравнений

Химические свойства металлов играют важную роль в решении различных уравнений. Металлы обладают свойством образования положительных ионов, которые могут участвовать в химических реакциях с другими веществами. Они способны переходить из одного степени окисления в другую, что существенно влияет на процесс решения уравнения.
Например, при решении уравнений реакций металлов с кислородом, учитывается степень окисления металла. Когда металл вступает в реакцию с кислородом, он окисляется, теряя электроны и образуя положительный ион. При этом, кислород восстанавливается, принимая электроны от металла. Таким образом, в уравнении реакции между металлом и кислородом, металл будет иметь положительную степень окисления, а кислород - отрицательную.
Кроме того, металлы могут образовывать соединения с разными элементами и ионами. Например, металлы могут образовывать соли с кислотами. При решении уравнений реакций металлов с кислотами, необходимо учесть степень окисления металла и ионов кислоты. Реакция металла с кислотой протекает с образованием соли и выделением водорода.
В общем, химические свойства металлов играют важную роль в решении уравнений, так как определяют характерные особенности реакций с другими веществами. Понимание этих свойств помогает составлять уравнения реакций и предсказывать их продукты.
Основные химические свойства металлов

1. Электроотрицательность: Металлы обладают низкой электроотрицательностью, что означает их способность отдавать электроны при химических реакциях. Это делает металлы хорошими проводниками электричества.
2. Окислительность: Металлы имеют свойство окисляться, т.е. терять электроны и образовывать катионы. Это происходит в химических реакциях с неметаллами или сильными окислителями.
3. Металлический блеск: Металлы обладают характерным металлическим блеском, который обусловлен способностью свободных электронов отражать свет.
4. Пластичность и хорошая теплопроводность: Металлы обладают высокой пластичностью, что позволяет им быть легко деформируемыми при нагреве. Они также обладают хорошей теплопроводностью, что позволяет им передавать тепло от одного места к другому.
5. Свойства амфотерности: Некоторые металлы, такие как алюминий и цинк, могут образовывать и кислотные и основные соединения. Они проявляют свойства амфотерности в зависимости от условий реакции.
6. Одно- и двухвалентность: Многие металлы могут образовывать как одновалентные, так и двухвалентные ионы в соединениях. Это зависит от их электронной конфигурации и положения в периодической системе.
7. Способность образовывать сплавы: Металлы имеют способность образовывать сплавы с другими металлами, что позволяет им менять свои физические и химические свойства. Сплавы широко используются в инженерии и промышленности.
Влияние химических свойств металлов на решение уравнений
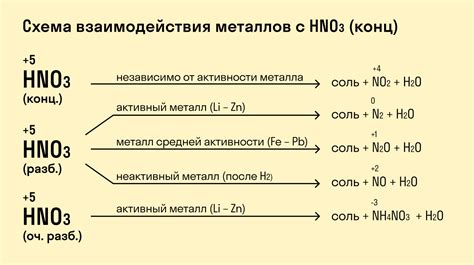
Химические свойства металлов играют важную роль при решении уравнений и определении их коэффициентов. Различные металлы проявляют разные способности к химическим реакциям, что должно быть учтено при балансировке уравнений.
Во-первых, металлы могут образовывать соединения с различными элементами, в том числе с кислородом, серой, и другими неметаллами. Это может привести к появлению различных окислительных состояний металла, которые должны быть учтены при решении уравнений.
Во-вторых, металлы могут образовывать ионы различных зарядов. Например, железо может образовывать ионы Fe2+ и Fe3+. Это также должно быть учтено при балансировке уравнений, чтобы сохранить электрическую нейтральность системы.
В-третьих, реакции с участием металлов часто сопровождаются изменением степени окисления атомов металла. Это означает, что при балансировке уравнений необходимо учесть изменение степени окисления, чтобы правильно определить коэффициенты перед соответствующими соединениями.
Итак, химические свойства металлов имеют значимое влияние на решение уравнений, поскольку они определяют реакционную способность металлов и их способность образовывать различные соединения. Учет этих свойств позволяет проводить более точные и достоверные расчеты в химических реакциях с участием металлов.
Методы решения уравнений с учетом химических свойств металлов

Решение уравнений, которые включают в себя реакции с металлами, требует применения специальных методов и учета химических свойств данных металлов. Одним из таких методов является метод окислительно-восстановительных реакций.
В этом методе основное внимание уделяется изменениям степени окисления атомов металла в процессе реакции. Металл может выступать в качестве окислителя, принимая электроны от другого вещества, или в качестве восстановителя, отдавая электроны. Изменения степени окисления металла позволяют составить уравнение реакции.
Другим методом решения уравнений с учетом химических свойств металлов является метод сочленения электронов. В этом методе учитывается количество электронов, передаваемых от металла к другому веществу. Металл может отдавать один или несколько электронов, в результате чего происходит формирование ионов металла с различными степенями окисления. С использованием этого метода можно определить стехиометрические коэффициенты в уравнении реакции с металлом.
Также для решения уравнений с учетом химических свойств металлов можно использовать таблицы степеней окисления и химических свойств металлов. В таблицах указываются различные степени окисления и свойства металлов, а также возможные реакции, в которых они могут участвовать. Обращаясь к таким таблицам, можно легко определить, какие ионы металла могут возникнуть, и составить уравнение реакции с учетом этих ионов.
Вопрос-ответ

Как решить уравнение химической реакции с участием металлов?
Для решения уравнения химической реакции с участием металлов необходимо соблюдать определенные правила. Во-первых, нужно обратить внимание на степень окисления металлов в реагентах и продуктах реакции. Затем, с учетом химических свойств металлов, нужно сбалансировать уравнение, добавляя к коэффициентам перед соответствующими веществами. Важно помнить, что металлы могут иметь разные степени окисления в разных реакциях.
Какова роль металлов в химических реакциях?
Металлы играют важную роль в химических реакциях. Они могут выступать в качестве восстановителей и окислителей, что позволяет происходить реакции окисления-восстановления. Металлы также могут образовывать соли с кислотами и участвовать в реакциях с кислородом или водой. В зависимости от своих химических свойств, металлы могут быть более активными или менее активными в химических реакциях.
Какие есть методы решения уравнений с учетом химических свойств металлов?
Для решения уравнений с учетом химических свойств металлов можно использовать различные методы. Один из них - это метод полуравновесной реакции, при котором уравнение реакции сбалансировано только частично. Затем по известным данным о свойствах металлов и их степенях окисления можно получить полное сбалансированное уравнение. Другой метод - это метод ион-электронного баланса, который основан на балансировке окислительно-восстановительных полуреакций. В обоих случаях важно учитывать химические свойства металлов и их реакционную способность.
