Не металлы - это класс элементов в периодической таблице, который обладает определенными химическими свойствами. Изучение этих свойств является важной частью химического образования и широко используется в науке и промышленности. В рефератах по химии часто рассматриваются различные аспекты химических свойств не металлов.
Одним из основных химических свойств не металлов является их способность образовывать ковалентные связи с другими элементами. Не металлы обладают высокой электроотрицательностью, что позволяет им притягивать электроны к своим атомам и образовывать молекулы совместно с другими не металлами или металлами. Это свойство не металлов определяет их роль в образовании соединений и влияет на их физические и химические свойства.
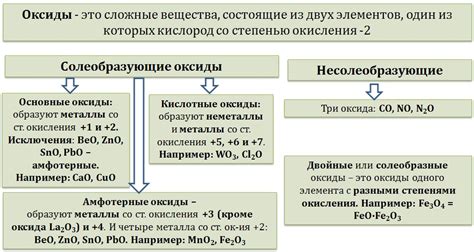
Еще одно важное химическое свойство не металлов - их способность к окислению. Многие не металлы имеют высокую активность и легко вступают в реакции с кислородом или другими окислителями. Это позволяет использовать не металлы в различных процессах окисления-восстановления, а также в производстве взрывчатых веществ, кислот и других химических соединений.
В рефератах по химии также можно рассмотреть различные свойства не металлов, такие как их электропроводность, химическая стойкость, взаимодействие с водой и растворами, а также их роль в живых организмах. Изучение химических свойств не металлов позволяет более глубоко понять их роль в различных химических процессах и применять их в различных областях науки и промышленности.
Определение и классификация не металлов
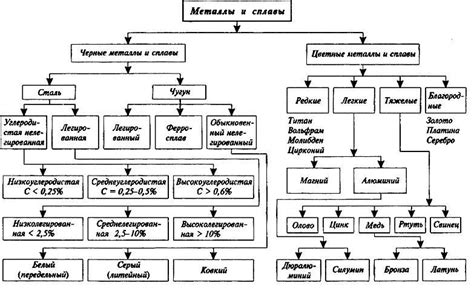
Неметаллами называют группу химических элементов, которые обладают некоторыми характеристиками, отличными от металлов. В отличие от металлов, не металлы обычно не обладают высокой электропроводностью и теплопроводностью, а также не образуют металлического блеска.
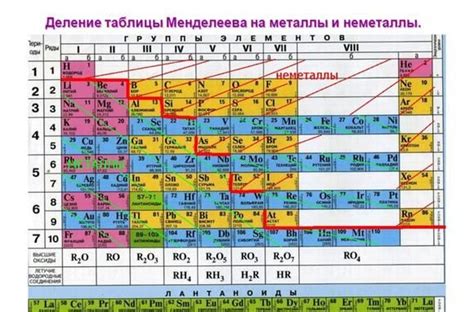
Не металлы могут быть классифицированы по различным признакам, таким как химические свойства, физические свойства, степень гибкости и другие характеристики. Включая элементы, такие как водород, углерод, азот, кислород, фосфор, сера, а также галогены и инертные газы.
Не металлы могут быть также классифицированы на основе их положения на периодической таблице. Не металлы включают элементы из групп 14, 15, 16 и 17, расположенные справа от металлов в периодической таблице. В этой области расположены элементы такие как углерод, фосфор, сера и йод.
Также не металлы можно классифицировать по их химической активности. Некоторые не металлы обладают высокой степенью реактивности и образуют химические соединения с другими элементами. Эти не металлы, такие как хлор, кислород и фтор, часто используются в процессе окисления других веществ.
Классификация не металлов является важным аспектом изучения химии и позволяет ученым лучше понять химические свойства и взаимодействия этих элементов. Обладая знаниями об определении и классификации не металлов, мы можем лучше понять исследуемые физические и химические процессы.
Физические свойства не металлов
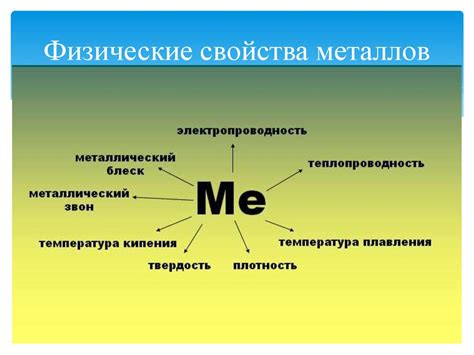
Не металлы – это элементы, обладающие свойством не проходить электрический ток в состоянии твердого тела. Физические свойства не металлов достаточно разнообразны и отличаются от свойств металлов.
Одной из основных физических характеристик не металлов является низкая плотность. Большинство не металлов имеют плотность значительно меньшую, чем плотность металлов. Например, плотность газообразного кислорода равна всего 1,43 кг/м3, в то время как плотность металлического железа составляет 7,87 кг/м3.
Не металлы обычно обладают низкой температурой плавления и кипения. Большинство из них плавятся при температурах ниже 300 градусов Цельсия, например, сера плавится при 115 градусах Цельсия, а йод при 113 градусах Цельсия.
Электропроводимость не металлов крайне низкая или отсутствует полностью. Исключения составляют некоторые полупроводники, которые могут проводить электрический ток при определенных условиях.
Не металлы обычно обладают хрупкостью. Единичные атомы не металлов образуют сильные ковалентные связи, что делает их неспособными к способности выдерживать внешнее давление без эффекта разрушения.
Один из важных физических признаков не металлов – химическая инертность. Не металлы обычно имеют высокую устойчивость к окислению и коррозии, что позволяет им удачно применяться в различных областях, таких как строительство и электроника.
Химические свойства не металлов в соединении с металлами

Не металлы обладают определенными химическими свойствами, которые проявляются при взаимодействии с металлами. В соединении с металлами не металлы могут проявлять свои особенности: кислотные, окислительные или просто нерастворимые свойства.
Некоторые не металлы образуют с металлами соли, например, хлор содает хлористую соль, сера может образовывать сульфид свинца, а фосфор образует фосфиды. В таких соединениях металлы проявляют свою химическую активность, а не металлы - химическую инертность.
Однако не все не металлы образуют с металлами соли. Например, металлы из группы инертных (гелий, неон, аргон) не образуют сольной соединений. Кроме того, они не агрессивны к металлам, они не окисляют, не реагируют с ними и не вступают в остальные химические реакции.
Также некоторые не металлы в соединении с металлами могут проявлять свои окислительные свойства. Кислород, хлор, бром, йод и их соединения могут окислять металлы, образуя с ними соответствующие оксиды или соли. Например, кислород способен окислять железо, образуя ржавчину.
Химические свойства не металлов в соединении с другими не металлами
Не металлы - это элементы, которые обладают недостатком электронов во внешней электронной оболочке. Когда не металлы соединяются с другими не металлами, образуются химические соединения, которые имеют свои химические свойства.
Не металлы в соединении с другими не металлами могут образовывать ионные или молекулярные соединения, в зависимости от того, как они обмениваются электронами при образовании соединения. Ионные соединения образуются, когда один не металл отдает электроны другому не металлу, образуя положительные и отрицательные ионы. Молекулярные соединения образуются, когда не металлы образуют совместно нельзя разъединить только одну молекулу, например, двуокись углерода (СО2) или азотная кислота (HNO3).
В химических соединениях, не металлы могут обладать различными степенями окисления в зависимости от их положения в периодической таблице и от связующих элементов. Например, водород и кислород могут соединяться, образуя воду (H2O), где кислород имеет степень окисления -2, а водород +1.
Все не металлы обладают различными химическими свойствами в соединении с другими не металлами. Например, кислород способен поддерживать горение, и поэтому может реагировать с большинством не металлов при высоких температурах. Хлор и фтор являются крайне активными не металлами и могут образовывать соединения с практически всеми элементами в периодической таблице.
Окислительные свойства не металлов
Не металлы обладают высокими окислительными свойствами и способностью принимать электроны от других веществ. Они стремятся к образованию ионов, имеющих большое отрицательное зарядное состояние.
Окислительные свойства не металлов проявляются при реакциях с металлами, где не металл выступает в роли окислителя, передавая электроны металлу. Например, хлор воздействует на натрий, образуя хлорид натрия и выделяя при этом энергию. В таких реакциях не металлы принимаются ионами с положительным зарядом.
Окислительные свойства не металлов проявляются также в реакциях с веществами, содержащими электроны с отрицательным зарядом. Не металлы образуют соединения с такими веществами, приводя к образованию соответствующих ионов и высвобождению энергии.
Не металлы также могут проявлять окислительные свойства в реакциях с водой. Они могут вступать в реакцию с водой, образуя оксиды, ионы гидроксида и выделяя при этом энергию.
Кислотные свойства не металлов

Не металлы могут образовывать кислоты, то есть вещества, которые обладают способностью образовывать положительные ионы в водном растворе. Кислотные свойства не металлов определяются их способностью взаимодействовать с основаниями и образовывать с ними соли.
Одним из примеров не металла с выраженными кислотными свойствами является сернистый газ, SO2. В растворах сернистый газ можно рассматривать как безводную серную кислоту. При контакте с водой сернистый газ образует сульфиты и диоксид серы.
Другим примером не металла с кислотными свойствами является водородный фторид, HF. При растворении в воде водородный фторид образует фториды и кислоту фтористоводородную, которая в свою очередь является очень сильным кислотным веществом.
Также можно отметить кислотные свойства хлора и серы, которые могут выступать в качестве окислителей и взаимодействовать с основаниями, образуя с ними соли.
Свойства не металлов в процессах окисления и восстановления
Не металлы обладают различными свойствами в процессах окисления и восстановления, которые определяют их химическую активность и способность вступать в различные химические реакции.
Одной из основных характеристик не металлов является их склонность к окислению – процессу, при котором не металлы образуют ионы повышенной степени окисления (катионы), потеряв электроны. При окислении не металлов происходят различные химические реакции, например, образование неорганических соединений с другими элементами.
Одновременно не металлы могут выступать в качестве восстановителей – веществ, которые способны принимать электроны в химических реакциях. В процессе восстановления не металлы образуют отрицательно заряженные анионы, приобретая электроны от других элементов. При этом образуются различные соединения, например, с водородом или металлами.
Не металлы могут проявлять различную активность в процессах окисления и восстановления в зависимости от их электроотрицательности, атомной структуры и особенностей электронного строения. Некоторые не металлы, например, кислород и хлор, являются сильными окислителями и легко вступают в реакции окисления, в то время как другие, такие как водород и фосфор, обладают возможностью вступать в реакции восстановления и выступать в качестве восстановителей.
Биологическая активность не металлов
Не металлы являются важными элементами для биологических систем. Они играют роль в обмене веществ, участвуют в регуляции физиологических процессов и влияют на здоровье организма.
Некоторые не металлы, такие как фосфор, сера и йод, являются важными составляющими биомолекул, таких как нуклеиновые кислоты, белки и липиды. Фосфор, например, присутствует в нуклеотидах, каталитических центрах ферментов и фосфолипидах, играя роль в передаче энергии и осуществлении клеточных функций.
Другие не металлы, такие как кислород и азот, встречаются в газовой форме и являются неотъемлемыми компонентами атмосферы. Кислород, например, необходим для клеточного дыхания и процесса окисления органических веществ для выделения энергии. Азот является составной частью аминокислот, белков и нуклеотидов.
Некоторые не металлы, такие как хлор и йод, также имеют противомикробные свойства и используются в медицинской терапии. Йод, например, является важным элементом для синтеза гормонов щитовидной железы и используется для профилактики йододефицитных заболеваний. Хлор, в свою очередь, используется для обеззараживания воды и поверхностей.
Вопрос-ответ

Какие свойства отличают не металлы от металлов?
Не металлы отличаются от металлов рядом свойств. Они имеют низкую теплопроводность и электропроводность, тугоплавкие и хрупкие при комнатной температуре, а также имеют низкую плотность.
Каковы особенности химических свойств не металлов?
У не металлов высокая электроотрицательность, то есть они способны сильно притягивать электроны. Кроме того, не металлы обычно образуют ковалентные связи, в которых электроны общего пользования.
Каково значение не металлов в химии и промышленности?
Не металлы являются важными элементами в химии и промышленности. Например, кислород, азот и сера являются ключевыми компонентами органических соединений, а хлор, фтор и бром используются как отдельные вещества и в составе различных химических соединений.
Какие еще свойства не металлов следует знать?
Не металлы обычно образуют кислоты, что позволяет им образовывать не металлические оксиды и гидриды. Они также могут образовывать ионы с отрицательным зарядом, называемые не металлическими ионами.
