Стандартный электродный потенциал - это характеристика активности металла, которая определяет его способность к окислению или восстановлению в реакции. Значение стандартного электродного потенциала позволяет сравнивать активность различных металлов и предсказывать, какие реакции смогут происходить при контакте с другими веществами.
Значение стандартного электродного потенциала обозначается как E₀ и измеряется в вольтах. Более активные металлы имеют более отрицательные значения электродного потенциала, что означает их большую склонность к окислению. Например, литий имеет наиболее отрицательное значение электродного потенциала, -3,04 В, что делает его очень реакционноспособным.
Стандартные электродные потенциалы также позволяют предсказывать направление и силу потенциальной разности между двумя полуэлементами. Если разница в электродном потенциале между двумя металлами положительна, то будет идти электронный ток от металла с более отрицательным значением потенциала к металлу с более положительным значением. Таким образом, можно определить, какие металлы будут реагировать между собой и какая сила этой реакции.
Металлическая активность: стандартные электродные потенциалы

Металлическая активность определяется стандартными электродными потенциалами, которые позволяют сравнивать активность различных металлов по их способности к окислительно-восстановительным реакциям. Величина стандартного электродного потенциала обозначается символом E°.
Стандартный электродный потенциал измеряется относительно стандартного водородного электрода (SHE), который имеет нулевой стандартный электродный потенциал. В зависимости от своего стандартного электродного потенциала металл может быть активным или пассивным.
Активные металлы имеют отрицательные стандартные электродные потенциалы, что говорит о их способности к окислению и распаду в растворе. К таким металлам относятся, например, цинк и алюминий. Пассивные металлы, наоборот, имеют положительные стандартные электродные потенциалы, что говорит о их устойчивости к окислительным процессам. Такие металлы, как золото и платина, мало взаимодействуют с окружающей средой.
Стандартные электродные потенциалы могут быть использованы для определения возможности возникновения окислительно-восстановительных реакций. Если стандартный электродный потенциал металла A больше, чем у металла B, то металл A будет окислять металл B в растворе. Это позволяет предсказать, какие реакции будут протекать при взаимодействии различных металлов в определенной среде.
Что такое электродные потенциалы

Электродные потенциалы - это показатели, характеризующие способность металла участвовать в электрохимических реакциях. Они измеряются в вольтах и являются мерой энергии, необходимой для переноса электрона с одного вещества на другое в электродной реакции.
Стандартные электродные потенциалы представляют собой значения электродных потенциалов, измеряемые при определенных условиях. Они используются для сравнения активности металлов и их способности действовать как восстановители или окислители в химических реакциях.
Знание стандартных электродных потенциалов важно для понимания электрохимических реакций и предсказания их направления. Металлы с более высокими стандартными электродными потенциалами обладают большей способностью снижать энергию и переносят электроны на более низкопотенциальные металлы или ионы.
Электродные потенциалы могут быть использованы для определения стойкости металлов к коррозии, выбора металла для использования в анодных и катодных материалах, а также для предсказания возможных электрохимических реакций при контакте различных металлов.
Значение стандартных электродных потенциалов
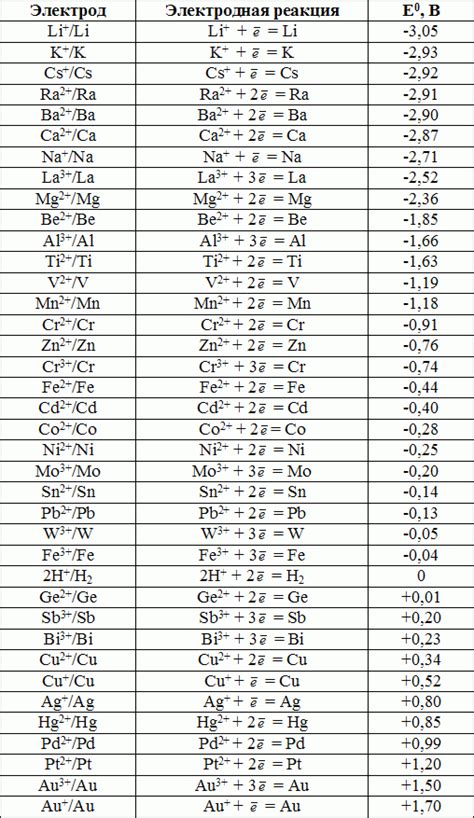
Стандартные электродные потенциалы являются важными характеристиками химических элементов и способны показать их активность в реакциях с водородом. Значение этих потенциалов измеряется в вольтах и определяется в отношении к 0,00 В - стандартному электродному потенциалу водорода.
Значение стандартного электродного потенциала для каждого химического элемента может быть положительным, отрицательным или равным нулю. Положительное значение стандартного электродного потенциала указывает на то, что элемент является активным и способен давать электроны в реакциях окисления-восстановления.
Например, у металла, обладающего положительным значением стандартного электродного потенциала, стремление отдавать электроны выше, чем у водорода. А у металла с отрицательным значением стандартного электродного потенциала, стремление отдавать электроны ниже, чем у водорода.
Таким образом, значения стандартных электродных потенциалов помогают определить активность металлов и их способность принимать или отдавать электроны в химических реакциях. Эти значения играют важную роль в электрохимии и находят применение в различных областях, включая гальванические элементы и электролиз.
Изменение электродных потенциалов при реакциях

Электродный потенциал металла может изменяться при его участии в химических реакциях. Это связано с изменением концентраций ионов металла в растворе, а также с изменением окислительно-восстановительных свойств реагирующих веществ.
При окислении металла его электродный потенциал может увеличиваться, поскольку он переходит в более высокую окислительную степень. Например, медь вступает в реакцию с нитратом серебра, в результате чего у меди происходит окисление, а ее электродный потенциал увеличивается.
Некоторые металлы имеют относительно стабильные электродные потенциалы и слабо изменяют их при участии в химических реакциях. Это связано с тем, что они образуют стабильные соединения в своих окислительных степенях. Например, железо имеет стандартный электродный потенциал, который слабо меняется при его окислении или восстановлении.
При реакциях между металлами с различными стандартными электродными потенциалами происходит течение электрического тока через реакционную среду. Это объясняется разностью электродных потенциалов металлов. Металл с более высоким электродным потенциалом окисляется, а металл с более низким потенциалом восстанавливается. Такие реакции называются гальваническими.
Практическое применение электродных потенциалов

Стандартные электродные потенциалы являются важным показателем активности металлов, который находит широкое применение в различных областях науки и техники.
В электрохимии электродные потенциалы используются для определения термодинамической стабильности различных соединений. Зная электродный потенциал металла, можно предсказать его склонность к окислению или восстановлению. Это позволяет выбирать оптимальные материалы для производства различных элементов и соединений.
Электродные потенциалы также используются в химическом анализе для определения содержания веществ в образцах. По изменению потенциала между двумя электродами можно судить о концентрации вещества, что позволяет проводить точный и быстрый анализ образцов.
В электролизе электродные потенциалы используются для управления процессом осаждения металлов. Путем подачи определенного потенциала на электрод можно контролировать скорость получения или качество осаждаемого металла.
Электродные потенциалы находят применение и в биологии. Они используются для изучения биологических процессов, таких как окислительно-восстановительные реакции, происходящие в организмах. Также электродные потенциалы могут использоваться для создания биосенсоров и электрохимических устройств для мониторинга биологических процессов.
Таким образом, знание и использование электродных потенциалов имеет большое практическое значение в различных отраслях науки и техники, позволяя контролировать и оптимизировать различные процессы и реакции.
Вопрос-ответ

Что такое стандартный электродный потенциал?
Стандартный электродный потенциал (Е0) - это значение электродного потенциала при стандартных условиях (температура 25°C, давление 1 атм, концентрации 1 М). Он позволяет сравнивать активности различных металлов и определять их способность вступать в реакцию окисления или восстановления.
Как определяется стандартный электродный потенциал?
Стандартный электродный потенциал определяется экспериментально. Для этого используется стандартная водородная электродная (SHE), которой присваивается произвольное значение 0 В. Далее проводятся измерения потенциалов различных полуреакций, относительно стандартного водородного электрода, и вычисляют их разность. Полученные значения и являются значениями стандартных электродных потенциалов различных металлов.
Как связаны стандартный электродный потенциал и активность металла?
Стандартный электродный потенциал напрямую связан с активностью металла. Чем выше значение стандартного электродного потенциала металла, тем большую склонность он проявляет к окислению. Металлы с положительными значениями стандартного электродного потенциала обладают большей активностью и большей способностью к окислению, чем металлы с отрицательными значениями стандартного электродного потенциала.
Какие значения стандартных электродных потенциалов металлов являются стабильными?
Значения стандартных электродных потенциалов металлов являются стабильными и характерными для каждого металла. Они не зависят от концентрации реагентов, температуры и давления. Поэтому эти значения могут быть использованы для сравнения активности различных металлов и прогнозирования их поведения в химических реакциях.
