Металлы и кислоты - это два ключевых компонента химической реакции, которые могут привести к различным эффектам и явлениям. Взаимодействие металла с кислотой - это процесс, в результате которого образуется соединение между ионами металла и ионами кислоты.
Одной из особенностей этого взаимодействия является то, что оно может происходить с выделением газа, тепла и света. Например, при взаимодействии металла с сильной кислотой, такой как соляная кислота, обычно выделяется водородный газ.
Реакции между металлами и кислотами можно классифицировать по нескольким признакам. Во-первых, они могут быть полностью или частично обратимыми реакциями, то есть возможна дальнейшая диссоциация или обратное превращение образовавшегося соединения. Во-вторых, реакции могут быть эндотермическими или экзотермическими в зависимости от того, поглощается или выделяется тепло в процессе.
Важно отметить, что некоторые металлы не реагируют с определенными кислотами из-за своей химической инертности, в то время как другие металлы могут реагировать с различными кислотами, независимо от того, являются ли они сильными или слабыми.
Взаимодействие металлов с кислотами является важным фундаментом в химии и имеет широкий спектр промышленных и научных применений. Изучение особенностей и классификации таких реакций помогает лучше понять принципы химических превращений и создать новые материалы и соединения с желаемыми свойствами.
Реакция взаимодействия металла с кислотой: общие принципы

Взаимодействие металла с кислотой – это химическая реакция, в которой металл вступает в контакт с кислотой, что приводит к образованию соответствующей соли и выделению водорода. Такие реакции являются одной из основных тем химии и имеют большое значение в промышленности и повседневной жизни.
Основным принципом взаимодействия металла с кислотой является образование активного иона металла, который замещает водород в кислоте. В результате этого образуются соль металла и молекула воды. Обычно металл с самым низким потенциалом восстановления из диапазона рассматриваемых металлов будет реагировать с кислотой, в то время как металлы с более высоким потенциалом будут нереактивны.
Существует несколько типов реакций взаимодействия металла с кислотой. Одним из наиболее распространенных является реакция с образованием соли и выделением газа водорода. Эта реакция может быть представлена уравнением:
2M(s) + 2HCl(aq) -> 2MCl(aq) + H2(g)
где M обозначает металл, а HCl – соляную кислоту.
Другим типом реакции является реакция взаимодействия металла с кислотой, при которой образуется соль и выделяется газ, отличный от водорода. Сюда можно отнести, например, реакцию алюминия с серной кислотой, при которой образуется соль алюминия и выделяется сернистый газ:
2Al(s) + 3H2SO4(aq) -> Al2(SO4)3(aq) + 3H2(g)
Также существует реакция взаимодействия металла с кислотой, при которой образуется соль и выделяется вода, а не газ. Например, реакция цинка с хлороводородной кислотой:
Zn(s) + 2HCl(aq) -> ZnCl2(aq) + H2O(l)
Таким образом, реакция взаимодействия металла с кислотой имеет различные варианты, в зависимости от металла и кислоты, вступающих в реакцию. Изучение этих реакций позволяет получить важные соли и газы, которые имеют применение в различных областях науки и промышленности.
Экзотермические реакции металла с кислотой: типы и характеристики
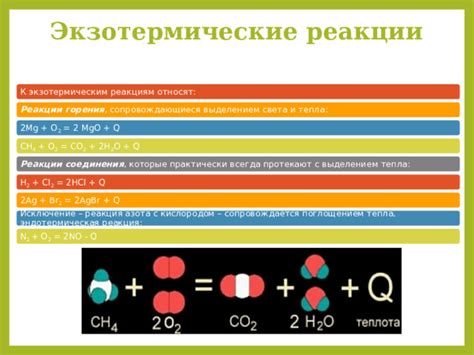
Взаимодействие металлов с кислотами является экзотермическим процессом, при котором происходит выделение тепла. Такие реакции часто сопровождаются образованием пузырьков газа и изменением цвета или состояния реагентов. В зависимости от типа кислоты и металла, с которыми она взаимодействует, реакции могут протекать по разным механизмам и иметь различные характеристики.
Одним из типов реакций металла с кислотой является замещение водорода. В результате этой реакции металл занимает место водорода в кислотном соединении, образуя соль и выделяяся газ. Например, при взаимодействии цинка с соляной кислотой образуется цинк хлорид и выделяется водородный газ:
2HCl + Zn → ZnCl2 + H2
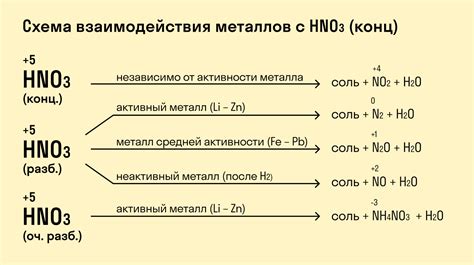
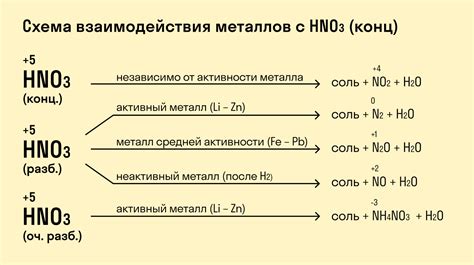
Другим типом реакций является окисление металла кислородом кислоты. В данном случае металл совершает переход на более высокую степень окисления, а кислород из кислоты становится водой. Например, при взаимодействии меди с азотной кислотой образуется нитрат меди и выделяется оксид азота:
4HNO3 + Cu → Cu(NO3)2 + 2NO2 + 2H2O
Некоторые металлы могут реагировать с кислородом кислоты, но не протекать самораспространяющимся способом. В этом случае процесс реакции требует нагревания или наличия катализатора для инициирования и поддержания реакции. Например, взаимодействие железа с серной кислотой происходит при нагревании и с образованием сульфата железа:
Fe + H2SO4 → FeSO4 + H2
Таким образом, экзотермические реакции металла с кислотой имеют различные типы и характеристики, зависящие от типа металла и кислоты, условий реакции и наличия катализаторов. Понимание этих особенностей позволяет контролировать и использовать данные реакции в различных технологических процессах и химических экспериментах.
Физические свойства металла и их влияние на реакцию с кислотой
Металлы обладают рядом физических свойств, которые оказывают влияние на реакцию с кислотой. Одно из важнейших свойств металла - его электропроводность. Зачастую металлы являются отличными проводниками электричества, что объясняет, почему реакция металла с кислотой сопровождается выделением электрического тока.
Еще одно важное физическое свойство металла, влияющее на реакцию с кислотой - его плотность. Металлы обычно обладают высокой плотностью, что делает их стабильными и помогает в проведении реакции с кислотой. Высокая плотность металла обеспечивает хорошую остойчивость кислоты и помогает осуществить полноценную реакцию.
Также важным физическим свойством металла является его термическая проводимость. Металлы обычно обладают высокой термической проводимостью, что позволяет реакции с кислотой проходить при высоких температурах. Благодаря этому металлы могут эффективно взаимодействовать с кислотой и обеспечивать хороший результат реакции.
Таким образом, физические свойства металла, такие как электропроводность, плотность и термическая проводимость, играют важную роль в реакции металла с кислотой. Они обеспечивают стабильность, эффективность и полноценность реакции, что позволяет получить нужный результат. При изучении и классификации реакций металла с кислотой необходимо учитывать и уделять внимание данным свойствам металла.
Классификация реакций металла с кислотой: основные группы и примеры
Реакции металлов с кислотами можно классифицировать на несколько основных групп в зависимости от характера процесса.
Первая группа реакций – это реакции, при которых металл активно взаимодействует с кислотой, выделяя гидроген. Например, реакция металла цинка с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2
Эта реакция происходит с выделением пузырьков газа в результате образования водорода.
Вторая группа реакций – это реакции, при которых металл не вступает в активное взаимодействие с кислотой, но при этом выделяется газ. Например, реакция металла меди с разбавленной серной кислотой:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
В этом случае металл не теряет своих свойств, но при взаимодействии с кислотой образуется оксид азота и вода.
Третья группа реакций – это реакции, при которых металл теряет свою химическую активность. Например, реакция металла свинца с серной кислотой:
Pb + H2SO4 → PbSO4 + H2
В этом случае металл свинца не вступает в активное взаимодействие с кислотой, а выделяется только водород.
Таким образом, реакции металлов с кислотами можно классифицировать по характеру процесса, что позволяет более подробно изучить их особенности и механизмы протекания.
Скорость и степень окисления металла в процессе взаимодействия с кислотой

При взаимодействии металла с кислотой происходит процесс окисления металла, то есть передача электронов от металла к кислороду. Скорость и степень окисления металла зависят от нескольких факторов.
Важным фактором является концентрация кислоты. Чем выше концентрация кислоты, тем быстрее происходит окисление металла. Высокая концентрация кислоты способствует более активному образованию ионов водорода, что ускоряет окисление металла.
Еще одним фактором, влияющим на скорость окисления металла, является температура реакции. При повышенной температуре реакция протекает быстрее, так как молекулы обладают большей энергией и частотой столкновений.
Поверхностная площадь металла также имеет значительное значение. Чем больше поверхностная площадь, тем больше мест для взаимодействия кислоты с металлом, что ускоряет процесс окисления.
Некоторые металлы, такие как алюминий и цинк, проявляют способность самозащиты. При взаимодействии с кислотой они образуют защитную пленку, которая препятствует дальнейшему окислению. Это делает окисление металла менее интенсивным.
Образование газов в результате реакции металла с кислотой: значения и применение
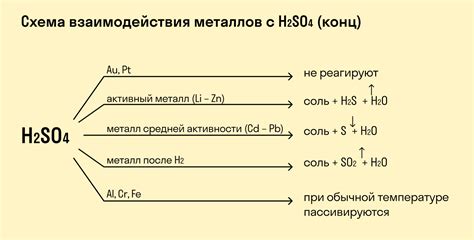
Реакция металла с кислотой может сопровождаться образованием газа, который играет важную роль в химических процессах и имеет различные значения и применение.
Одним из самых распространенных примеров реакции металла с кислотой, при котором образуется газ, является реакция металла с соляной кислотой. В результате этой реакции образуется хлорид металла и выделяется водород. Водород является легким и горючим газом, который может быть использован в различных сферах деятельности, включая промышленность, энергетику и научные исследования.
Еще одной значимой реакцией, при которой образуется газ, является реакция металла с серной кислотой. В этом случае образуется сульфат металла и выделяется диоксид серы. Диоксид серы имеет широкое применение в производстве серной кислоты, а также используется в качестве консерванта, антиоксиданта и вещества для выведения кожных инфекций.
У ряда металлов, таких как цинк, алюминий и железо, реакция с кислотой может протекать с образованием водорода. Водород, получаемый в результате этих реакций, может быть использован в процессах водородной энергетики, например, для производства электроэнергии или использования водородных топливных элементов.
Таким образом, образование газов при реакции металла с кислотой имеет важное значение и может быть применено в различных сферах деятельности. Оно открывает новые возможности для использования получаемых газов и способствует развитию энергетики и промышленности.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Реакция металла с кислотой возможна только с активными металлами как, например, натрий, калий, магний. Пассивные металлы, такие как серебро или золото, не реагируют с кислотами.
Как длительные реакции металлов с кислотами могут привести к образованию газов?
При длительном взаимодействии металлов с кислотами могут образовываться газы. Например, реакция цинка с соляной кислотой приводит к выделению водорода, а реакция алюминия с соляной кислотой образует хлороводородный газ.
