Взаимодействие металлов с кислотами – это один из основных процессов в химии. Этот тип реакций называется реакцией замещения или еще реакцией окисления-восстановления.
Реакция замещения протекает при контакте металла с кислотой и заключается в замещении водорода атомом металла. В результате реакции образуется соль металла и выделяется молекулярный водород.
Свойства металлов и кислот играют важную роль в данном процессе. Для проведения успешной реакции необходимо, чтобы металл имел достаточную активность, чтобы замещать водород. Кислота также должна быть достаточно реакционноспособной, чтобы отдавать свой протон металлу.
Реакция взаимодействия металла с кислотой имеет большое практическое применение. Она используется для получения различных продуктов, таких как соли металлов или газы, а также в процессах очистки от нежелательных примесей. Важно соблюдать безопасность при проведении данной реакции, так как она может сопровождаться выделением опасных газов или жидкостей.
Реакция взаимодействия металла с кислотой

Реакция взаимодействия металла с кислотой – это химический процесс, при котором металл вступает в реакцию с кислотой и образуется соль и выделяется водород. Кислота является донором протона, который передается металлу, вызывая его окисление.
Основной роль в реакции взаимодействия металла с кислотой играет процесс замещения, когда ионы металла вытесняют ионы водорода из кислоты. Этот процесс происходит из-за разности активности металла и водорода. Активность металла зависит от его места в электрохимическом ряде. Металлы, находящиеся выше в ряду, более активны и способны замещать металлы, находящиеся ниже в ряду.
Существуют два основных типа реакции взаимодействия металла с кислотой: соляная и солевая. В соляной реакции образуется соль, состоящая из катиона металла и аниона кислоты. В солевой реакции образуется дополнительно вода. Например, реакция взаимодействия цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода:
- Зн + 2HCl -> ZnCl₂ + H₂.
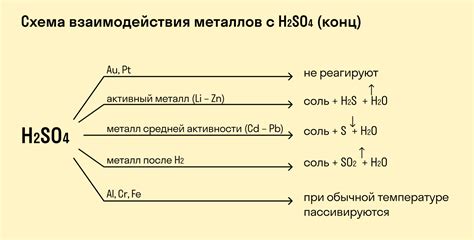
Реакция взаимодействия металла с кислотой может происходить при комнатной температуре или в результате нагревания. Также важно отметить, что не все металлы реагируют с кислотами. Некоторые металлы, такие как золото и платина, химически инертны и не вступают в реакцию с кислотами.
Основная роль реакции замещения

Реакция замещения – это химическая реакция, при которой атомы одного вещества вытесняют атомы другого вещества из соединения. В контексте взаимодействия металла с кислотой, реакция замещения играет основную роль.
Когда металл вступает в реакцию с кислотой, происходит замещение атомов водорода в молекуле кислоты атомами металла. В результате образуется соль металла и выделяется молекула водорода. Эта реакция имеет важное промышленное значение.
Замещение водорода в кислоте атомом металла объясняется тем, что в данном случае атом металла обладает большей активностью. Активность металла зависит от его положения в ряду активности металлов и способности отдавать электроны.
Реакции замещения металла с кислотой также происходят в организме живых организмов. Например, в организме человека железо вступает в реакцию с кислородом из воздуха, что приводит к образованию оксида железа. Этот процесс осуществляется благодаря реакции замещения.
Таким образом, реакция замещения играет важную роль во взаимодействии металлов с кислотой, способствуя образованию солей и выделению вещества. Она имеет значение как в промышленности, так и в биологических процессах. Это позволяет глубже понять и изучать химические реакции и их влияние на окружающую среду.
Реакция металла с кислотой: процесс и механизм взаимодействия
Реакция металла с кислотой является химическим процессом, который происходит при взаимодействии металла с кислотным раствором. В результате этой реакции происходит образование соли и выделение газа.
Механизм взаимодействия металла с кислотой основывается на принципе реакции замещения. Кислота, действуя как окислитель, отбирает электроны у металла, что приводит к его окислению. В результате происходит образование положительно заряженного иона металла и водорода.
При этом, не все металлы реагируют с кислотами. У каждого металла есть своя активность, то есть способность вступать в химические реакции. Например, активные металлы, такие как натрий или калий, легко реагируют с кислотами, образуя соли и выделяя газ водород. В то время как менее активные металлы, например, медь или серебро, не реагируют с обычными кислотами.
Реакция металла с кислотой играет важную роль в промышленности и быту. Например, реакция цинка с соляной кислотой используется для получения водорода, который широко применяется в процессе химического синтеза различных веществ. Кроме того, реакция металла с кислотой может применяться для очистки поверхности металлических изделий от окислов и других загрязнений.
Какие металлы реагируют с кислотой и какие не реагируют
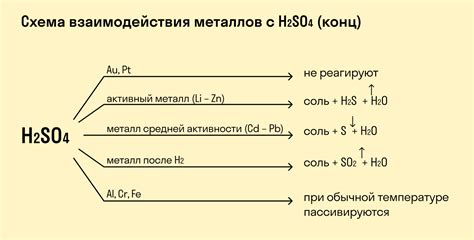
Реакция взаимодействия металлов с кислотами является одной из основных реакций химического процесса. Кислоты могут реагировать с различными металлами и образовывать соли и выделяться водород.
Активные металлы, такие как натрий, калий, магний и цинк, способны реагировать с кислотами. Обычно они вытесняют из раствора водород и образуют соли. Например, реакция между соляной кислотой и цинком приводит к образованию хлорида цинка и выделению водорода.
Однако некоторые металлы, такие как медь, серебро и золото, не реагируют с обычными кислотами. Их поверхность покрывается защитной пленкой оксида, которая предотвращает дальнейшее взаимодействие с кислотой. Эти металлы считаются химически инертными.
Некоторые металлы, такие как железо и алюминий, могут реагировать только с определенными кислотами. Например, железо может реагировать с соляной кислотой или серной кислотой, но не с уксусной кислотой.
Также стоит отметить, что реакция взаимодействия металлов с кислотами может протекать только в определенных условиях. Например, для реакции с металлом может потребоваться наличие подходящей концентрации кислоты или наличие воды в реакционной среде.
Таблица ниже приводит примеры некоторых металлов и их способность к реакции с различными кислотами:
| Металл | Соляная кислота (HCl) | Серная кислота (H2SO4) | Уксусная кислота (CH3COOH) |
|---|---|---|---|
| Натрий (Na) | Да | Да | Нет |
| Магний (Mg) | Да | Да | Нет |
| Цинк (Zn) | Да | Да | Нет |
| Медь (Cu) | Нет | Нет | Нет |
| Железо (Fe) | Да | Да | Нет |
Из таблицы видно, что активные металлы, такие как натрий, магний и цинк, реагируют с обеими кислотами, тогда как некоторые другие металлы, такие как медь и алюминий, не реагируют с ними.
Факторы, влияющие на скорость реакции металла с кислотой
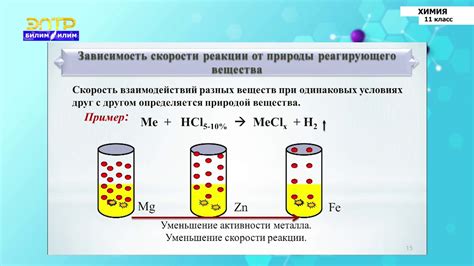
1. Вид металла. Реакция металла с кислотой зависит от его активности. Активные металлы, такие как натрий или калий, реагируют с кислотой быстро и интенсивно. В то время как менее активные металлы, например железо или цинк, обладают меньшей скоростью реакции.
2. Концентрация кислоты. Чем выше концентрация кислоты, тем быстрее протекает реакция с металлом. Высокая концентрация кислоты создает более благоприятные условия для взаимодействия с металлом и ускоряет химическую реакцию.
3. Температура. Повышение температуры увеличивает скорость реакции металла с кислотой. При повышенной температуре молекулы кислоты и металла движутся быстрее, что способствует более сильному столкновению и взаимодействию.
4. Площадь поверхности металла. Если поверхность металла имеет большую площадь, то реакция протекает быстрее. Это связано с тем, что большая площадь обеспечивает большее количество активных центров, которые могут вступить в реакцию с кислотой.
5. Наличие катализаторов. Некоторые вещества, называемые катализаторами, могут ускорять химическую реакцию без изменения своей структуры. В присутствии катализаторов реакция металла с кислотой может протекать более быстро и эффективно.
6. Размер частиц металла. Если металл находится в виде мелких частиц или порошка, то реакция протекает быстрее. Мелкие частицы металла имеют большую площадь поверхности, что способствует более активному взаимодействию с кислотой.
7. Размер и форма сосуда. Реакция металла с кислотой может зависеть от размера и формы сосуда, в котором она проводится. Например, металл может реагировать быстрее в узкой колбе по сравнению с широким стаканом, что связано с интенсивным перемешиванием реакционной смеси.
Все эти факторы влияют на скорость реакции металла с кислотой и их учет позволяет контролировать процесс и достигать требуемых результатов.
Примеры реакций металлов с различными кислотами
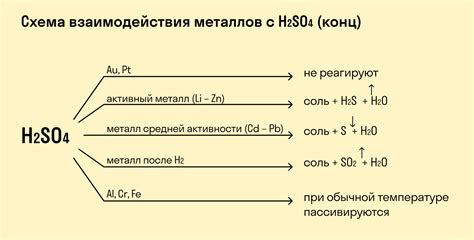
1. Реакция алюминия с соляной кислотой:
Алюминий имеет большую активность и способен вступать в реакцию с различными кислотами. Взаимодействие алюминия с соляной кислотой приводит к образованию соли и выделению водорода. Уравнение реакции:
2Al + 6HCl → 2AlCl3 + 3H2
2. Реакция железа с серной кислотой:
Железо активно взаимодействует с серной кислотой, образуя соль и выделяя диоксид серы и воду. Уравнение реакции:
Fe + H2SO4 → FeSO4 + SO2 + H2O
3. Реакция меди с азотной кислотой:
Медь, вступая в реакцию с азотной кислотой, образует нитрат меди и оксид азота. Уравнение реакции:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
4. Реакция цинка с уксусной кислотой:
Цинк реагирует с уксусной кислотой, образуя ацетат цинка и выделяя водород. Уравнение реакции:
Zn + 2CH3COOH → Zn(CH3COO)2 + H2
5. Реакция свинца с соляной кислотой:
Свинец реагирует с соляной кислотой, образуя соль свинца и выделяя водород. Уравнение реакции:
Pb + 2HCl → PbCl2 + H2
Все перечисленные реакции относятся к типу реакций замещения, когда металл вытесняет из раствора другой металл, образуется соль, а в выделенном газе водород. Такие реакции являются одним из основных способов получения солей металлов.
Использование реакции металла с кислотой в промышленности и повседневной жизни
Реакция металла с кислотой – это один из фундаментальных и широко используемых процессов в промышленности и повседневной жизни. Во-первых, такие реакции активно применяются в химической промышленности для получения различных продуктов. Например, реакция цинка с соляной кислотой позволяет получить хлорид цинка – важное сырье для производства гальванических покрытий и других химических соединений.
Во-вторых, реакции металла с кислотой имеют широкое применение в электротехнике и энергетике. Многие электролитические батареи и аккумуляторы основаны на реакции цинка с серной кислотой или свинца с серной кислотой. Эти реакции позволяют преобразовывать химическую энергию в электрическую и использовать ее для питания устройств или хранения энергии.
Также реакции металла с кислотой находят применение в повседневной жизни. Например, различные бытовые очистители в туалете и ванной комнате содержат кислотные компоненты, которые взаимодействуют с металлическими отложениями и ржавчиной, обеспечивая их удаление и предотвращая повреждение поверхностей.
В целом, реакция металла с кислотой является важным и универсальным процессом, позволяющим получать нужные продукты, использовать энергию, а также поддерживать гигиену и сохранять целостность материалов в повседневной жизни и промышленности.
Вопрос-ответ

Как происходит реакция взаимодействия металла с кислотой?
При взаимодействии металла с кислотой происходит реакция окисления-восстановления, в результате которой выделяются газы и образуются соли.
Какая роль играет реакция замещения во взаимодействии металла с кислотой?
Реакция замещения является основным типом реакции при взаимодействии металла с кислотой. В ходе этой реакции ионы металла вытесняют ионы водорода из кислоты, образуя соль и выделяя молекулы газа.
Какие металлы реагируют с кислотами?
Реагировать с кислотами могут различные металлы, такие как металлы щелочных металлов (например, натрий и калий), металлы щелочноземельных металлов (например, магний и кальций) и некоторые другие металлы, включая алюминий, цинк, железо и свинец.
