Одной из одной из важных и широко распространенных реакций в химии является реакция окисления-восстановления. Эта реакция происходит между веществами, в результате которой одно вещество окисляется, а другое восстанавливается. Такие реакции играют важную роль в аналитической химии, промышленных процессах и в жизни организмов.
Одной из таких реакций является реакция водорода с оксидами металлов. В процессе этой реакции водород действует в качестве восстановителя, т.е. он позволяет металлу в оксиде уменьшить свою степень окисления. В результате этой реакции оксид металла превращается в металл, а молекулы воды формируются в результате окисления водорода.
Реакция водорода с оксидами металлов является весьма энергичной и экзотермической, то есть сопровождается выделением тепла. Она может протекать как при нормальных условиях температуры и давления, так и при повышенных температурах. Некоторые оксиды металлов сильно реакционны и сразу начинают гореть при контакте с водородом.
Такая реакция может быть очень полезной в промышленности. Например, с помощью реакции водорода с оксидами металлов можно получать металлы из их оксидов, что имеет большое значение в металлургии и производстве различных изделий. Также, реакция водорода с оксидами металлов используется в химическом анализе, чтобы определить содержание металла в оксиде.
Таким образом, реакция водорода с оксидами металлов является примером реакции окисления-восстановления, в которой водород выступает в качестве восстановителя, а оксид металла окисляется. Эта реакция имеет широкое применение в различных областях, от промышленности до химического анализа, и играет важную роль в химии и жизни человека.
Реакция водорода с оксидами металлов: реакция окисления-восстановления

Реакция водорода с оксидами металлов является характерным примером реакции окисления-восстановления. В этом типе реакции водород работает как восстановитель, а оксид металла - как окислитель.
Водород способен вступать в реакцию с оксидами различных металлов, образуя воду и элементарный металл. При этом оксид металла подвергается окислению, теряет кислород, а водород восстанавливается, получая электроны.
Реакция водорода с оксидами металлов происходит при нагревании или взаимодействии в растворе. В результате образуется вода и диоксид металла, если он существует в двух молекулярных формах.
Примером реакции водорода с оксидом меди может служить следующее уравнение:
CuO + H2 → Cu + H2O
Такие реакции широко применяются в промышленности и лабораторных условиях для получения элементарных металлов и воды. Они также могут использоваться в аналитической химии для определения содержания веществ в образцах.
Реакция водорода с оксидами металлов - это важный процесс, который позволяет проводить восстановление и окисление различных веществ. Она имеет большое значение для понимания и изучения химических реакций и применима во многих областях науки и техники.
Влияние реакции водорода на оксиды металлов

Реакция водорода с оксидами металлов является реакцией окисления-восстановления, которая играет важную роль в химических превращениях. При этой реакции металл в окисленном состоянии переходит в восстановленное, а водород восстанавливается до молекулярного состояния.
Оксиды металлов могут взаимодействовать с водородом при нагревании или в присутствии катализаторов. В результате реакции образуется вода, а металл освобождается от кислорода.
Реакция водорода с оксидами металлов может использоваться для получения металлов из их окислов. Например, реакцией водорода с оксидом железа (FeO) можно получить металлическое железо. При этом оксид железа превращается в воду, а водород восстанавливается и выделяется в виде газа.
Влияние реакции водорода на оксиды металлов важно также с точки зрения использования этого процесса в промышленности. Реакция водорода с оксидами металлов является одним из способов получения металлов, и она может применяться для массового производства. Кроме того, этот процесс позволяет избежать применения вредных химических веществ и снизить нагрузку на окружающую среду.
В общем, реакция водорода с оксидами металлов является важным процессом, который позволяет получать металлы из их окислов и имеет большое значение в промышленности. Она также подтверждает принципы окисления-восстановления и широко используется в химии для реакций превращения и синтеза различных веществ.
Оксиды металлов: роль в реакции окисления-восстановления
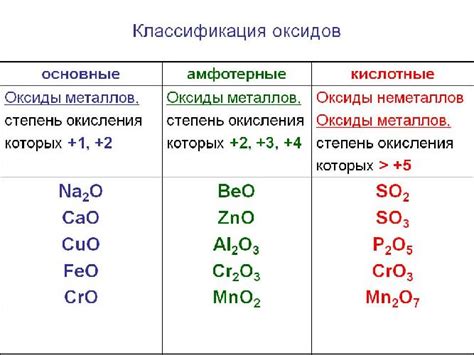
Оксиды металлов играют важную роль в реакциях окисления-восстановления, демонстрируя свои химические свойства. В процессе реакции, оксиды металлов могут выступать как окислители, что означает, что они получают электроны от других веществ, или как восстановители, отдавая электроны.
Основной представитель оксидов металлов - водородный оксид (вода). В реакции с различными оксидами металлов, водород претерпевает окисление, а металлы - восстановление. Механизм таких реакций напрямую связан с химической активностью металлов и их способностью отдавать электроны.
Примером может служить реакция между водородом и оксидом меди (II) CuO, где медь в оксиде находится в двухвалентном состоянии. В ходе реакции, оксид меди CuO превращается в металлическую медь Cu, а водород H2 окисляется до воды H2O. Таким образом, медь выступает в роли восстановителя, а водородный оксид – в роли окислителя.
Такие реакции не только проясняют роль оксидов металлов в реакциях окисления-восстановления, но и имеют практическое значение. Например, водородная энергетика основана на этой реакции, используя водород в качестве восстановителя для получения электроэнергии.
Реакция окисления-восстановления: примеры реакции водорода с оксидами металлов

Реакция водорода с оксидами металлов является примером реакции окисления-восстановления, где происходит одновременное окисление одного вещества и восстановление другого.
Одним из известных примеров такой реакции является взаимодействие водорода с оксидом железа (Fe2O3), который получается при окислении железа воздухом. При нагревании оксида железа с водородом образуется металлическое железо и вода:
3Fe2O3 + H2 → 2Fe3O4 + H2O
В этой реакции водород восстанавливается, переходя из состояния элемента в состояние соединения с кислородом, а оксид железа окисляется, теряя кислород.
Еще одним примером реакции водорода с оксидами металлов является взаимодействие водорода с оксидом меди (CuO). При нагревании оксида меди с водородом образуется металлическая медь и вода:
CuO + H2 → Cu + H2O
В этом случае водород восстанавливается, а оксид меди окисляется, происходит переход кислорода от оксида к водороду.
Такие реакции окисления-восстановления, в которых водород выступает в роли восстановителя, а оксиды металлов – в роли окислителя, являются важными процессами в химии и применяются в различных областях, включая производство металлов и горение топлива.
Вопрос-ответ

Что такое реакция окисления-восстановления?
Реакция окисления-восстановления (редокс-реакция) — это химическая реакция, в которой происходит одновременное окисление одних веществ и восстановление других.
Почему реакция водорода с оксидами металлов является реакцией окисления-восстановления?
Реакция водорода с оксидами металлов является реакцией окисления-восстановления, потому что в процессе этой реакции водород окисляется (получает положительный заряд), а металл в оксиде восстанавливается (теряет положительный заряд).
В чем заключается значение реакции окисления-восстановления?
Реакции окисления-восстановления имеют большое значение в химии и многих других областях. Они играют важную роль в энергетике, биохимии, производстве различных веществ и материалов, а также в процессе дыхания и обмена веществ в организмах живых существ.
