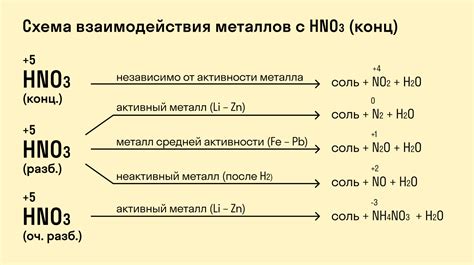
Реакция металла с водным раствором серной кислоты является одной из основных реакций, которые изучают в химии. В ходе этой реакции происходит взаимодействие металла с серной кислотой, при котором образуются соли и выделяется водород.
Реакция между металлом и серной кислотой может протекать с разной интенсивностью, в зависимости от свойств металла. Некоторые металлы реагируют с серной кислотой очень активно, с развитием пламени и выделением большого количества водорода, в то время как другие металлы реагируют гораздо медленнее и менее интенсивно.
Реакция металла с серной кислотой часто используется для демонстрации и объяснения основных законов химии, таких как закон сохранения массы и закон простой и кратной пропорциональности. Кроме того, эта реакция имеет практическое применение, например, в процессе получения солей и водорода.
Вода, металлы и кислоты
Вода - один из самых распространенных на Земле химических соединений. Свою широкую распространенность она обязана своим уникальным физическим и химическим свойствам. Вода является универсальным растворителем и играет важную роль во многих химических реакциях.
Металлы - это класс химических элементов, которые отличаются высокими электропроводностью и благоприятной структурой для создания металлических связей. Металлы имеют широкий спектр применений, от строительства и производства машин до электроники и медицины.
Кислоты - это класс химических соединений, которые обладают свойствами протонных доноров и могут растворять многие вещества, включая металлы. Кислоты играют важную роль в промышленности, медицине и научных исследованиях.
Реакция металла с водным раствором серной кислоты представляет собой химическую реакцию, в результате которой металл растворяется, образуя сульфат и выделяя водород. Реакция происходит по следующей схеме:
- Металл + серная кислота → сульфат металла + водород
При этой реакции образуется большое количество тепла, поэтому необходимо быть осторожным при ее проведении. Реакция металла с водным раствором серной кислоты является типичным примером реакции кислоты с металлом, которая широко применяется в химической промышленности и научных исследованиях.
Реакция металла с водным раствором серной кислоты

Реакция металла с водным раствором серной кислоты является одной из наиболее распространенных химических реакций. Она основана на взаимодействии активного металла с серной кислотой, в результате которого образуются соли серной кислоты и выделяется водородный газ.
В процессе реакции металл с серной кислотой образует соответствующую соль, а водород выпускается в виде газа. Некоторые металлы, такие как цинк, железо и алюминий, активно реагируют с серной кислотой, быстро выделяя водород и образуя соли.
Реакция металла с серной кислотой может происходить при обычном температурном режиме, однако для активных металлов процесс ускоряется при нагревании. При этом металл полностью растворяется, а реакция протекает очень быстро.
Важно отметить, что при взаимодействии активных металлов с более концентрированными растворами серной кислоты может возникать выделение вредных газов, поэтому необходимо соблюдать соответствующие меры предосторожности и работать в хорошо проветриваемом помещении или в вытяжной шахте.
Реакция металла с водным раствором серной кислоты имеет широкое применение в химической промышленности и лабораторной практике, а также используется в учебных целях для изучения химических свойств металлов и кислот.
Химические свойства металлов

Металлы - это группа химических элементов, обладающих рядом характерных свойств. Они обычно характеризуются блеском, проводимостью тепла и электричества, а также способностью образовывать ионы положительного заряда при химических реакциях.
Реакция металлов с водой является одним из основных химических свойств металлов. Многие металлы, такие как натрий, калий и кальций, реагируют со взрывом воды, выделяясь водородом и образуя гидроксид металла.
Также металлы могут реагировать с кислотами, что является важным химическим свойством. Например, реакция реакция цинка с серной кислотой приводит к образованию гидроксид цинка и выделению бурого газа.
Некоторые металлы, такие как железо, часто подвергаются окислению при взаимодействии с кислородом воздуха. Это металлургический процесс, который приводит к образованию ржавчины на поверхности металла.
Интересно, что металлы также могут образовывать сплавы с другими металлами или неметаллами. Примером таких сплавов являются бронза (медь и олово) и латунь (медь и цинк).
В целом, металлы имеют разнообразные химические свойства, которые делают их важным и неотъемлемым компонентом современной промышленности и технологий.
Реакция металлов с жидкостью

Реакция металлов с жидкостью - это процесс взаимодействия металлических элементов с различными жидкостями, которые может быть как вода, так и различные химические растворы, например, кислоты или щелочи.
При взаимодействии металлов с жидкостью происходит ряд физико-химических процессов. В зависимости от свойств используемых металлов и жидкости реакция может протекать с различной интенсивностью и способом.
Одним из распространенных примеров реакции металлов с жидкостью является реакция металлов с водой. Например, щелочные металлы, такие как натрий, калий и литий, реагируют с водой, образуя гидроксиды и выделяя водород. Эта реакция происходит очень быстро и с выделением значительного количества энергии. В то же время, реакция большинства металлов с водой является крайне нежелательной и может привести к разрушению металла или его окислению.
Реакция металлов с растворами кислот также является важным аспектом в химии. Например, реакция железа с серной кислотой приводит к образованию сульфата железа и выделению водорода. Многие металлы реагируют с кислотами с образованием солей и выведением водорода.
Некоторые металлы могут реагировать не только с водой или кислотами, но и с другими жидкостями. Например, реакция алюминия с гидроксидом натрия приводит к образованию алюминия гидроксида и выделению водорода.
Итак, реакция металлов с жидкостью является важным процессом, который может приводить к образованию новых соединений, выделению газа или другим химическим реакциям. Изучение этих реакций позволяет более глубоко понять химические свойства металлов и их взаимодействие с окружающей средой.
Водный раствор серной кислоты

Водный раствор серной кислоты представляет собой смесь молекул кислоты и воды. Серная кислота (H2SO4) является одним из наиболее распространенных и сильных минеральных кислот, используемых в промышленности и лабораториях.
При растворении серной кислоты в воде происходит ионизация молекул, образуя гидроксонийные и сульфатные ионы. Гидроксонные ионы (H3O+) отвечают за кислотную реакцию, а сульфатные ионы (SO4^2-) являются основным ан
Интеракция металла и раствора серной кислоты
Интеракция металла и раствора серной кислоты — это процесс, при котором металл взаимодействует с водным раствором серной кислоты, приводя к химической реакции. Результатом этого взаимодействия обычно является образование соли металла и выделение газа.
В ходе реакции металл и серная кислота обмениваются ионами: металл отдает электроны, становясь положительно заряженным ионом, а серная кислота принимает электроны, превращаясь в отрицательно заряженные ионы. В результате этой реакции образуется соль металла, растворимая в воде, и выделяется газ.
Скорость реакции между металлом и раствором серной кислоты зависит от различных факторов, включая концентрацию серной кислоты, температуру, поверхность металла и наличие катализаторов. Например, поверхность металла влияет на скорость реакции: чем больше площадь поверхности металла, тем быстрее происходит взаимодействие с раствором серной кислоты.
Одним из примеров реакции металла с серной кислотой является взаимодействие цинка и серной кислоты. При этой реакции образуется соль цинка и выделяется водородный газ. Реакция протекает по следующей схеме:
- Серная кислота (H2SO4) обменивается ионами с поверхностью цинка (Zn), при этом цинк отдает два электрона и образуется положительно заряженный ион Zn2+.
- Серная кислота принимает электроны, образуя водородные ионы H+ и анионы sulfate (SO42-).
- Образовавшаяся соль цинка, ZnSO4, растворяется в воде.
- Выделяется газ водород (H2), который можно обнаружить с помощью запускающей палочки.
Общая химическая формула реакции между цинком и серной кислотой выглядит следующим образом: Zn + H2SO4 → ZnSO4 + H2.
Кинетика и энергетика реакции
Реакция металла с водным раствором серной кислоты происходит с определенной кинетикой и энергетикой. Кинетика реакции связана с ее скоростью, то есть с тем, как быстро происходят изменения веществ. Одним из ключевых факторов, определяющих скорость реакции, является активность металла. Чем выше активность металла, тем быстрее протекает реакция.
Энергетика реакции, в свою очередь, определяется энергетическими изменениями, сопровождающими протекание реакции. В случае реакции металла с водным раствором серной кислоты, основной энергетической характеристикой является энтальпия реакции. Энтальпия реакции показывает, сколько теплоты выделяется или поглощается при протекании реакции.
Процесс взаимодействия металла с водным раствором серной кислоты может происходить с различной кинетикой и энергетикой в зависимости от условий, в которых происходит реакция. Так, например, температура, концентрации реагентов, физическое состояние реагентов и другие факторы могут существенно влиять на скорость и энергетику реакции.
Важно отметить, что взаимодействие металла с водным раствором серной кислоты может иметь как экзотермический характер (при выделении теплоты), так и эндотермический (при поглощении теплоты). Это связано с тем, что реакция сопровождается либо выделением, либо поглощением энергии.
Вопрос-ответ

Какой металл реагирует с водным раствором серной кислоты?
Реакцию с водным раствором серной кислоты можно провести с различными металлами, такими как цинк, железо, алюминий и т.д. Однако, обычно для данной реакции используются металлы, реакция которых проходит легко и быстро, например, цинк и железо.
Как происходит реакция металла с водным раствором серной кислоты?
В реакции металла с водным раствором серной кислоты образуется соль и выделяется водород. Металл реагирует с серной кислотой, отдавая свои электроны и окисляясь. В результате этой реакции образуется двухвалентный положительный ион металла в соли, а водород выделяется в виде газа. Это обычно сопровождается пузырьками и шипением.
