Азотная кислота – важное химическое вещество, которое широко применяется в различных отраслях науки и промышленности. Одним из интересных свойств азотной кислоты является ее взаимодействие с металлами. Реакция металлов с солью азотной кислоты обладает несколькими особенностями и находит применение в различных областях.
При контакте азотной кислоты с поверхностью металла происходит реакция окисления, в результате которой образуется нитрат металла. Например, реакция железа с азотной кислотой приводит к образованию нитрата железа. Эта реакция характеризуется сильным выделением дыма, парами и высокой скоростью. Такая реакция позволяет использовать нитраты металлов в качестве окрасок, удобрений и катализаторов в промышленности.
Кроме того, реакция металлов с солью азотной кислоты может использоваться в качестве способа очистки и обезжиривания металлических поверхностей перед нанесением защитного покрытия. Эта реакция обладает эффективностью и широким спектром применения. Кислотно-оксидные растворы азотной кислоты используются при обработке металлов перед нанесением лака, эмали или гальванического покрытия.
Таким образом, реакция металлов с солью азотной кислоты представляет собой важный процесс, имеющий значительные применения в различных областях. Знание особенностей и условий этой реакции позволяет эффективно использовать ее для получения различных продуктов и материалов, а также для обработки металлических поверхностей.
Металлы и их химические свойства

Металлы - это группа химических элементов, которые обладают специфическими физическими и химическими свойствами. Они обладают высокой теплопроводностью и электропроводностью, а также относительно низким плавлением и кипением.
Химические свойства металлов определяются их реакцией с другими веществами. Металлы обладают способностью образовывать ионы положительной зарядности, катионы. Образование катионов является характерным свойством металлов и связано с их стремлением к наиболее стабильной электронной конфигурации.
Металлы имеют разнообразные химические свойства в зависимости от своей положительной зарядности. Некоторые металлы могут взаимодействовать с кислотами, растворяясь в них и образуя соли. Другие металлы проявляют активность при вступлении в реакцию с неметаллами, образуя ионные соединения.
Окисление металлов
Металлы могут подвергаться окислению при взаимодействии с кислородом, образуя оксиды металлов. Окисление металлов также может происходить в реакции с водой, выделяя водородный газ. В зависимости от активности металла, скорость реакции окисления может быть разной.
Реакция металлов с неорганическими соединениями
Металлы могут проявлять активность в реакциях с неорганическими соединениями. Например, металлы могут вступать в реакцию с солями, образуя осадок или растворяясь в солевом растворе. Реакция металлов с солью азотной кислоты - один из примеров таких реакций.
Азотная кислота: состав и свойства
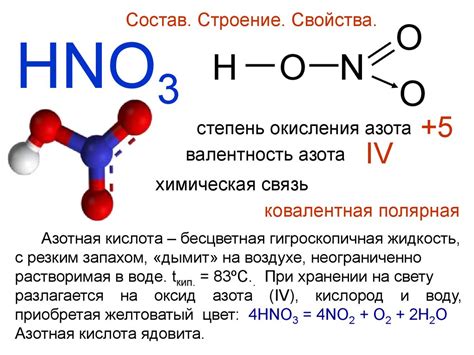
Азотная кислота (HNO3) - химическое соединение, состоящее из атомов водорода (H), азота (N) и кислорода (O). Она представляет собой безцветную или слабо окрашенную жидкость с ярким запахом.
Азотная кислота является сильным окислителем и кислотой. Она легко реагирует с многими веществами, в том числе с металлами, образуя соли. Эта реакция часто сопровождается выделением дыма и тепла.
Азотная кислота обладает высокой степенью коррозивного действия на различные материалы, включая кожу, одежду, дерево и металлы. Поэтому при работе с ней необходимо соблюдать особые меры предосторожности.
Свойства азотной кислоты во многом определяют ее применение. Она активно используется в химической промышленности для производства удобрений, пластмасс, взрывчатых веществ и других продуктов. Также азотная кислота находит применение в лабораторной практике и других научных исследованиях.
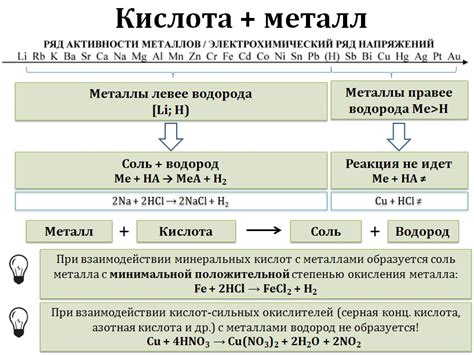
Реакция металлов с азотной кислотой
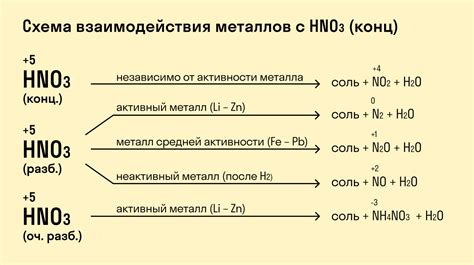
Реакция металлов с азотной кислотой является одной из наиболее распространенных и важных в химии. Эта реакция происходит при контакте активных металлов с азотной кислотой, которая является сильным окислителем.
В ходе реакции металлы окисляются азотной кислотой, а сами кислота превращается в азотную соль и воду. При этом выделяется обильное количество газообразного азотного оксида, который можно заметить по интенсивному красному цвету газовых выделений.
Реакция металлов с азотной кислотой имеет несколько особенностей. Например, активные металлы, такие как натрий, калий и магний, реагируют с азотной кислотой очень быстро и ярко, выделяя большое количество тепла. Менее активные металлы, например, алюминий или цинк, образуют пассивную пленку, что замедляет скорость реакции и уменьшает ее интенсивность.
Реакция металлов с азотной кислотой имеет широкое применение. Наиболее распространенное применение этой реакции – получение азотных солей, которые используются в различных отраслях промышленности, включая производство удобрений, взрывчатых веществ и пиротехники. Кроме того, данная реакция находит применение в аналитической химии, для определения содержания металлов в различных смесях и растворах.
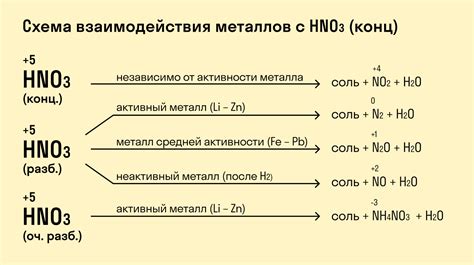
Типы реакций металлов с азотной кислотой
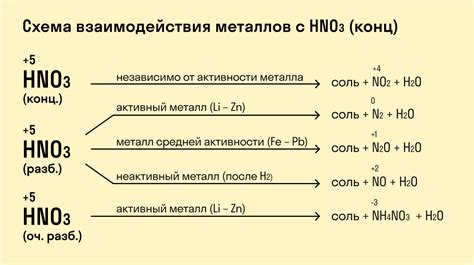
Реакция металлов с азотной кислотой является химической реакцией, которая включает взаимодействие металлов с азотной кислотой, приводящее к образованию соответствующих солей и выделению газообразных продуктов.
Реакции металлов с азотной кислотой могут быть различными в зависимости от химической активности металла. Активные металлы, такие как натрий, калий и магний, реагируют с азотной кислотой с выделением водорода.
Происходящая в данном случае реакция может быть представлена уравнением:
Металл + HNO3 → Соответствующая соль + H2
Более реактивные металлы, такие как цинк, железо и алюминий, реагируют с азотной кислотой с образованием азотных оксидов и соответствующих солей.
Уравнение для реакции алюминия с азотной кислотой может иметь следующий вид:
2Al + 6HNO3 → 2Al(NO3)3 + 3H2O + 2NO
Также возможна реакция нереактивных металлов, таких как золото и платина, с азотной кислотой, но она происходит очень медленно или практически не происходит из-за низкой активности данных металлов.
Реакция металлов с азотной кислотой имеет широкий спектр применений, как в химическом анализе, так и в промышленности. Она используется для получения различных солей, используемых в производстве удобрений, пищевых добавок, медикаментов и других химических веществ.
Применение реакции металлов с азотной кислотой
Реакция металлов с азотной кислотой обнаружила широкое применение в различных областях.
Во-первых, данная реакция используется в химическом анализе для определения наличия и концентрации металлов. За счет взаимодействия металла с азотной кислотой образуется нитрат металла, который можно детектировать с помощью специальных методов, таких как спектрофотометрия. Такой анализ позволяет получить надежные результаты и определить наличие определенного металла в исследуемой смеси.
Во-вторых, реакция металлов с азотной кислотой может применяться в практической химии для получения нитратов металлов. Полученные нитраты широко используются в качестве катализаторов, при производстве пиротехнических смесей, в аналитической химии и других отраслях промышленности.
Также данная реакция может быть полезной для обучения студентов в химических лабораториях. Изучение реакции металлов с азотной кислотой позволяет студентам лучше понять свойства и химическую активность различных металлов. Это помогает им развить навыки лабораторной работы, улучшить понимание основ химии и приобрести опыт взаимодействия различных веществ.
Особенности проведения реакции металлов с солью азотной кислоты
Реакция металлов с солью азотной кислоты является химической реакцией, в результате которой образуется оксид металла и нитрат кислоты. Эта реакция имеет несколько особенностей, которые необходимо учитывать при ее проведении.
Во-первых, при проведении реакции необходимо обеспечить безопасность, так как соль азотной кислоты является едким веществом, а при реакции может выделяться ядовитый газ – оксид азота. Поэтому рекомендуется проводить ее только в специальных условиях – в химической лаборатории или под надлежащим наблюдением квалифицированного специалиста.
Во-вторых, реакция между металлом и солью азотной кислоты может протекать с разной скоростью в зависимости от свойств металла. Некоторые металлы, такие как медь или свинец, реагируют с азотной кислотой очень медленно, в то время как другие, такие как цинк или железо, реагируют намного быстрее. Это нужно учитывать при выборе металла для проведения реакции.
В-третьих, реакция металлов с солью азотной кислоты может сопровождаться выделением тепла. Это означает, что при проведении реакции следует быть осторожным и избегать возможности получения ожогов или травмирования в результате повышенной температуры.
Таким образом, проведение реакции металлов с солью азотной кислоты требует особой осторожности и соблюдения мер безопасности. Важно учитывать особенности свойств металлов и азотной кислоты, а также контролировать процесс реакции для достижения желаемого результата.
Примеры реакций металлов с азотной кислотой
Реакция металлов с азотной кислотой может иметь различные характеристики в зависимости от свойств металла и условий реакции. Например, некоторые металлы сильно реагируют с азотной кислотой, проявляя сильное окислительное действие, в то время как другие металлы реагируют медленнее и проявляют слабое окислительное действие.
Один из примеров реакции металлов с азотной кислотой – реакция железа. Железо может реагировать с азотной кислотой, образуя нитрат железа и выделяя оксиды азота. Эта реакция может происходить при обычных условиях, именно поэтому при хранении железа необходимо применять соответствующую защиту.
Другим примером реакции металла с азотной кислотой является реакция алюминия. При взаимодействии алюминия с азотной кислотой происходит образование нитрата алюминия и выделение газа – оксида азота. При этой реакции алюминий сильно реагирует с азотной кислотой, поэтому процесс требует особой осторожности и проведения в хорошо проветриваемом помещении.
Также можно привести пример реакции магния с азотной кислотой. При реакции магния с азотной кислотой образуется нитрат магния, а также выделяется газ – оксид азота. Реакция магния с азотной кислотой происходит с выделением большого количества тепла, поэтому может сопровождаться ярким свечением и пламенем.
Таким образом, реакция металлов с азотной кислотой может иметь различные характеристики в зависимости от свойств металла и условий реакции. Это важный процесс, который может найти применение в различных областях, включая химическую промышленность, производство удобрений и другие.
Вопрос-ответ

Какие металлы реагируют с солью азотной кислоты?
Соль азотной кислоты может реагировать с различными металлами, но наиболее активно реагируют металлы, такие как медь, железо, цинк и свинец.
Как происходит реакция металлов с солью азотной кислоты?
При реакции металл с солью азотной кислоты происходит образование соответствующей соли и оксида азота. Например, медь и соль азотной кислоты взаимодействуют по следующему уравнению: 3Cu + 8HNO3 -> 3Cu(NO3)2 + 2NO + 4H2O
Каково применение реакции металлов с солью азотной кислоты?
Реакция металлов с солью азотной кислоты используется в различных областях, включая химическую промышленность, лабораторные исследования и производство взрывчатых веществ. Например, реакция меди с солью азотной кислоты используется для получения медных солей, которые имеют широкое применение в электротехнике и гальванике.
