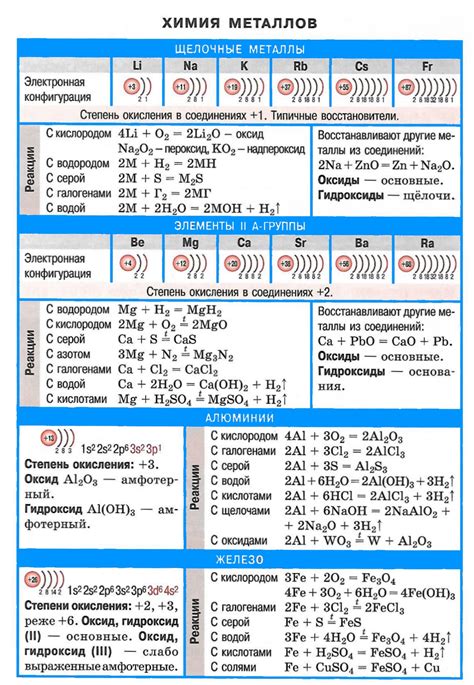
Реакция щелочных металлов с водой является одной из наиболее изученных и понятных химических реакций. При взаимодействии щелочных металлов (натрия, калия и др.) с водой происходит образование гидроксидов и выделение водорода.
В реакции щелочных металлов с водой важную роль играет их химическая активность. Щелочные металлы активным образом вступают в реакцию с водой, которая протекает с достаточно большим выделением энергии. При этом металлы распадаются на положительные ионы и электроны.
Образование гидроксидов при реакции щелочных металлов с водой является одним из основных продуктов. В результате взаимодействия ионов металла с гидроксид-ионами (OH-) образуется гидроксид металла. Этот продукт выделяется в виде осадка или растворяется в воде, образуя щелочные растворы. Еще одним продуктом реакции является выделение молекул водорода (H2), которые образуют пузырьки газа на поверхности металла.
Таким образом, реакция щелочных металлов с водой является энергичной и очень интересной химической реакцией, в результате которой образуются гидроксиды и выделяется водород. Изучение этой реакции имеет важное значение для понимания основных закономерностей химии и применения щелочных металлов в различных областях науки и промышленности.
Реакция щелочных металлов с водой: образование гидроксида металла и выделение водорода

Реакция щелочных металлов с водой является одной из самых известных и широко изучаемых химических реакций. К щелочным металлам относятся литий, натрий, калий, рубидий и цезий. При контакте этих металлов с водой происходит образование соответствующей гидроксидной соли металла (гидроксида лития, натрия, калия и т.д.) и выделение газообразного водорода.
Гидроксиды щелочных металлов, образующиеся в результате данной реакции, являются щелочными соединениями. Они обладают выраженными щелочными свойствами и, как правило, растворяются в воде с образованием щелочного раствора. Гидроксиды этих металлов характеризуются высокой щелочностью и широким спектром применения в различных отраслях промышленности и научных исследованиях.
Выделение водорода при реакции щелочных металлов с водой является результатом их активности и низкого потенциала окисления. Щелочные металлы обладают низкой электроотрицательностью, что позволяет им выделяться восставшими электродами в системе "металл-вода". В результате их химической реакции с водой электроны переходят на протоны, что приводит к образованию молекул водорода и ионов гидроксида металла.
Образование гидроксида металла и выделение водорода при реакции щелочных металлов с водой имеет большую практическую и научную значимость. Эта реакция широко используется в химической промышленности, при производстве энергии, а также в химических лабораториях для получения чистого водорода и изучения свойств гидроксидов ищелочных металлов.
Щелочные металлы: общие характеристики
Щелочные металлы - это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к химическому классу сильных щелочных металлов и характеризуются рядом общих свойств.
Первым характеристическим свойством щелочных металлов является низкая плотность. Они являются самыми легкими металлами и имеют плотность меньше, чем у большинства других элементов. Так, например, плотность лития составляет всего 0,534 г/см³, тогда как плотность свинца, наиболее плотного металла, составляет 11,34 г/см³.
Второй характеристикой щелочных металлов является высокая реакционность с водой. При контакте с водой они проявляют экзотермическую реакцию, сопровождаемую выделением водорода и образованием гидроксида щелочного металла. Это свойство связано с тем, что щелочные металлы имеют низкую ионизационную энергию и легко отдают электроны при взаимодействии с другими веществами.
Третий характеристическим свойством щелочных металлов является высокая электропроводность. Они обладают высокой электропроводностью как в твердом, так и в жидком состоянии, поскольку ионы щелочных металлов имеют высокую подвижность и способность проводить электроны.
Наиболее распространенным щелочным металлом является натрий, который широко применяется в производстве металлов, стекла, щелочей и других химических соединений. Щелочные металлы также используются в качестве катализаторов иаккумуляторных элементов
Химические свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий, натрий, калий, рубидий, цезий и франций. Они характеризуются рядом уникальных химических свойств, проявляющихся при взаимодействии с различными веществами.
Одним из ключевых свойств щелочных металлов является их способность активно реагировать с водой. При контакте с водой они выделяются водород, который может воспламеняться под действием воздуха.
Другим важным свойством щелочных металлов является их способность образовывать соли. Они образуют ионные соединения с анионами, образуя такие соли, как хлориды, нитраты и сульфаты. Также щелочные металлы могут образовывать комплексные соединения с некоторыми органическими веществами.
Щелочные металлы также обладают высокой фотохимической активностью. Они способны образовывать фотолюминесцентные соединения, которые используются в процессе синтеза оптических материалов.
Некоторые щелочные металлы проявляют способность образовывать сплавы и легировать другие металлы, увеличивая их прочность и коррозионную стойкость.
Использование щелочных металлов в различных областях химии и промышленности обусловлено их уникальными химическими свойствами. Они играют важную роль в процессах синтеза, катализа и производстве различных материалов.
Механизм реакции щелочных металлов с водой

Реакция щелочных металлов с водой является одной из основных химических реакций в неорганической химии. Она происходит между щелочным металлом и молекулой воды, приводя к образованию гидроксида металла и выделению водорода. Это реакция, которая может быть опасной и взрывоопасной, поэтому требует предельной осторожности при ее проведении.
Механизм реакции щелочных металлов с водой начинается с ионизации молекул воды с образованием гидроксидных и оксидных ионов. Щелочный металл, например натрий, реагирует с гидроксидными и оксидными ионами, образуя соединение типа гидроксида металла и молекулы воды. Это реакционное уравнение можно представить следующим образом:
2Na + 2H2O → 2NaOH + H2
В результате реакции образуется гидроксид натрия и молекула воды, а также выделяется молекула водорода. Эта реакция идет экзотермически, то есть с выделением тепла, что можно наблюдать в виде образования пузырьков водорода и нагревания реакционной смеси.
Важным параметром для характеристики реакции щелочных металлов с водой является скорость ее протекания. Она зависит от многих факторов, включая температуру, концентрацию реагентов и растворителя, а также наличие катализаторов. Высокая температура и повышенная концентрация реагентов способствуют ускорению реакции, а использование катализаторов может значительно повысить скорость протекания реакции.
Образование гидроксида металла: свойства и применение

Гидроксиды металлов представляют собой химические соединения, которые образуются в результате реакции металла с водой или щелочью. Эти соединения обладают рядом существенных свойств и находят широкое применение в различных сферах деятельности.
Гидроксиды металлов обычно обладают высокой растворимостью в воде, что делает их удобными для использования в различных химических процессах. Они обладают щелочными свойствами и могут взаимодействовать с кислотами, образуя соли.
Одно из важных свойств гидроксидов металлов - их щелочная реакция. Они способны нейтрализовать кислоты и применяются в качестве антацидных веществ для устранения изжоги и изысканного пищеварительного дискомфорта.
В промышленности гидроксиды металлов находят свое применение в качестве щелочных растворов для очистки и обезвреживания отходов. Они используются в процессе обработки сточных вод, а также в качестве реагентов в текстильной и пищевой промышленности.
Гидроксиды металлов также применяются в косметической и фармацевтической промышленности. Они используются в качестве сырья для производства различных препаратов, косметических средств и средств гигиены. Гидроксид кальция, например, является одним из основных компонентов зубной пасты.
Таким образом, гидроксиды металлов - это важные химические соединения, которые обладают свойствами щелочных соединений. Их применение находит широкое применение в различных сферах деятельности, включая промышленность, медицину и косметологию.
Выделение водорода при реакции щелочных металлов с водой

Реакция щелочных металлов с водой - одно из наиболее характерных явлений, проявляющихся в химической активности этих элементов. При контакте щелочных металлов (например, лития, натрия или калия) с водой происходит взаимодействие, в результате которого выделяется водородный газ.
Процесс выделения водорода при реакции щелочных металлов с водой является эндотермическим, то есть требующим затраты энергии для своего осуществления. Это происходит из-за того, что водород входит в состав воды, и для его выделения необходимо разорвать химические связи между атомами воды.
В процессе реакции щелочные металлы образуют гидроксиды, а водород образует устойчивое соединение с гидроксидом щелочного металла. Выделение водорода происходит в результате протекания двух последовательных реакций: сначала металл реагирует с водой, образуя гидроксид и выделяющуюся энергию, а затем гидроксид металла реагирует с водородом, образуя воду и выделяющийся водородный газ.
Выделение водорода при реакции щелочных металлов с водой является чрезвычайно важным явлением, так как водород широко используется в качестве восстановителя, топлива, а также в химической промышленности и других отраслях. Реакция щелочных металлов с водой демонстрирует химическую активность этих элементов и может быть использована в качестве учебного эксперимента для изучения свойств щелочных металлов и их реактивности.
Важность реакции щелочных металлов с водой в природе и промышленности
Реакция щелочных металлов с водой играет важную роль в природе и промышленности. Эта реакция является основой для получения водорода, который является одним из самых важных химических элементов.
Щелочные металлы, такие как литий, натрий и калий, обладают способностью быстро реагировать с водой, образуя гидроксиды и высвобождая водород. Водород является чрезвычайно полезным источником энергии, его можно использовать в процессах синтеза аммиака, водородного перекиси и других химических веществ.
Одна из самых известных промышленных реакций с участием щелочных металлов и воды - это процесс электролиза. В этом процессе, щелочные металлы преобразуются в гидроксиды, а водород и кислород выделяются.
Кроме того, реакция щелочных металлов с водой имеет важное значение в природе. Например, образование гидроксидов щелочных металлов при контакте с водой в почве влияет на ее pH значение и определяет ее кислотность или щелочность. Это, в свою очередь, влияет на различные химические и биологические процессы, происходящие в почве и в растениях.
Таким образом, реакция щелочных металлов с водой играет важную роль как в природе, так и в промышленности. Она является основой для получения водорода, который является энергетическим и химическим источником, а также влияет на pH значение почвы и оказывает влияние на различные биологические процессы.
Вопрос-ответ

Какие реакции происходят между щелочными металлами и водой?
Реакция щелочных металлов с водой приводит к образованию щелочных гидроксидов и выделению водорода. Например, при взаимодействии натрия с водой образуется гашеная сода (гидроксид натрия) и выделяется водородный газ. Аналогичные реакции происходят и с другими щелочными металлами - калием, литием, рубидием и цезием.
Почему при реакции щелочных металлов с водой выделяется водород?
Выделение водорода при взаимодействии щелочных металлов с водой связано с их активностью. Щелочные металлы, такие как натрий, калий, литий, обладают высокой активностью, что означает их готовность отдать электроны. В результате реакции с водой, где вода выступает в качестве окислителя, металл отдаёт электроны и превращается в катион, а вода превращается в гидроксид и получает электроны. Выделение водорода происходит за счет того, что образовавшиеся отщепленные электроны не могут находиться в водородной молекуле и образуют водородный газ.
