Щелочные металлы - группа элементов таблицы химических элементов, которые характеризуются высокой реактивностью и способностью образовывать щелочные растворы при взаимодействии с водой. К этой группе относятся литий, натрий, калий, рубидий, цезий и франций.
При контакте с водой, щелочные металлы активно взаимодействуют с молекулами воды, образуя гидроксиды. Например, натрий при контакте с водой образует щелочной раствор натрия и выделяет водород. Такая реакция происходит очень быстро и сопровождается выделением значительного количества тепла.
Щелочные растворы обладают рядом характеристик, которые делают их полезными в различных областях. Они обладают высокой щелочностью и хорошо растворяются в воде. Кроме того, они способны нейтрализовать кислоты, образуя соли и воду. Это свойство находит применение в производстве щелочей, моющих средств, гальванических элементов и других промышленных процессах.
Щелочные металлы и их реакция
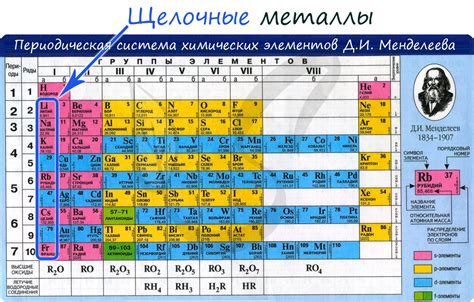
Щелочные металлы представляют собой группу химических элементов периодической системы, включающую литий, натрий, калий, рубидий, цезий и франций. Они отличаются своими химическими свойствами, включая высокую реактивность при взаимодействии с водой.
Реакция щелочных металлов с водой является одной из основных характеристик этих элементов. При контакте с водой щелочные металлы образуют щелочные растворы и выделяются водород. Эта реакция происходит очень быстро и сопровождается выделением тепла и газообразными пузырьками.
Например, калий реагирует с водой, образуя гидроксид калия (щелочь) и выделяя водород:
2K + 2H2O → 2KOH + H2
Цезий, самый реактивный из щелочных металлов, реагирует с водой еще более интенсивно, создавая сверкающие вспышки и выделяя водородный газ. Это делает цезий опасным для использования и хранения.
Свойства щелочных растворов
Щелочные растворы, образующиеся при реакции щелочных металлов с водой, обладают рядом характерных свойств. Они имеют высокий pH (более 7), что делает их щелочными. Кроме того, они являются отличными проводниками электричества и хорошо растворяются в воде.
Щелочные растворы широко используются в промышленности и быту. Они применяются в процессах очистки, при производстве мыла и моющих средств, а также в производстве различных химических соединений. Кроме того, щелочные растворы используются в медицине, например, для укола или обработки раны.
Водородные щелочные металлы и их свойства

Щелочные металлы - это металлы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти металлы обладают высокой химической активностью, особенно в сухом воздухе и при контакте с водой.
Щелочные металлы обладают свойством образовывать щелочные растворы при реакции с водой. Этот процесс происходит с выделением водорода и образованием гидроксидов щелочных металлов. Например, литий реагирует с водой, образуя гидроксид лития (LiOH) и выделяя водород (H2):
2Li + 2H2O → 2LiOH + H2
Щелочные металлы являются отличными редуцирующими агентами. Они легко окисляются воздухом, образуя оксиды щелочных металлов. Эти оксиды являются мощными основаниями и взаимодействуют с водой, образуя гидроксиды. Например, натрий окисляется до оксида натрия воздухом:
4Na + O2 → 2Na2O
И оксид натрия взаимодействует с водой, образуя гидроксид натрия (NaOH):
Na2O + H2O → 2NaOH
Другим важным свойством щелочных металлов является их способность образовывать соли. Они образуют соли с различными кислотами, например, солями, нитратами, сульфатами и другими. Эти соли широко используются в различных областях, включая промышленность, медицину и сельское хозяйство.
Водородные щелочные металлы имеют множество важных применений и неотъемлемую роль в нашей жизни. Их химические свойства и реактивность делают их полезными в различных технологиях и процессах.
Щелочные металлы и химические реакции

Щелочные металлы – это элементы, расположенные в первой группе периодической системы Менделеева. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой химической активностью и способны с легкостью вступать в реакцию с различными веществами.
Одной из самых известных реакций щелочных металлов является их реакция с водой. При контакте с водой, щелочные металлы образуют гидроксиды. Например, натрий вступает в реакцию с водой и образует гидроксид натрия (NaOH) и выделяется водород (H2):
2Na + 2H2O → 2NaOH + H2
Эта реакция сопровождается выделением значительного количества тепла и образованием щелочного раствора. Гидроксиды щелочных металлов обладают щелочными свойствами и могут нейтрализовать кислоты.
Щелочные металлы также реагируют с кислородом воздуха, при этом образуется оксид металла. Например, литий реагирует с кислородом и образует оксид лития (Li2O):
4Li + O2 → 2Li2O
Кроме того, щелочные металлы могут реагировать с другими веществами, например, с аммиаком. Натрий вступает в реакцию с аммиаком и образует идентифицированный продукт – аммиакат натрия (NaNH2):
2Na + 2NH3 → 2NaNH2 + H2
Таким образом, щелочные металлы проявляют высокую химическую активность и способны вступать в реакцию с различными веществами, образуя новые соединения.
Щелочные металлы и их способность к образованию растворов
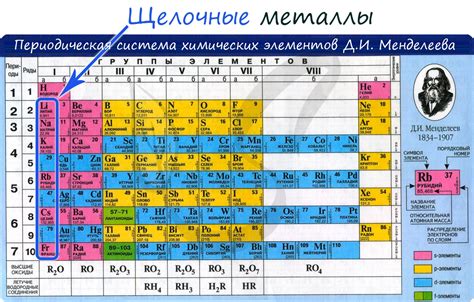
Щелочные металлы – это группа химических элементов, которые обладают особой способностью к образованию растворов при реакции с водой. В эту группу входят такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Когда щелочные металлы вступают в реакцию с водой, они образуют щелочные растворы, которые являются основными и имеют высокий уровень pH. Этот процесс называется гидратацией и происходит из-за сильного взаимодействия между металлом и молекулами воды.
Щелочные металлы обладают высокой реакционной способностью, поэтому реакция с водой происходит достаточно интенсивно. При этом выделяется водородный газ, который можно наблюдать в виде пузырьков, всплывающих на поверхности раствора.
Реакция щелочных металлов с водой является экзотермической, то есть сопровождается выделением тепла. Это объясняется тем, что при гидратации металлов освобождается большое количество энергии.
Из-за своей реакционной способности щелочные металлы широко используются в различных областях. Например, калий применяется в сельском хозяйстве как удобрение, а натрий используется в пищевой промышленности для приготовления различных продуктов.
Таким образом, щелочные металлы обладают уникальной способностью к образованию растворов при гидратации. Их реакция с водой является интенсивной и сопровождается выделением тепла. Понимание этого процесса позволяет использовать щелочные металлы в различных отраслях промышленности и науки.
Реакция щелочных металлов с водой

Щелочные металлы - это элементы первой группы периодической системы, такие как литий, натрий, калий и другие. Они обладают металлическими свойствами и характеризуются высокой активностью в реакциях с водой.
При взаимодействии щелочных металлов с водой происходит химическая реакция, в результате которой образуется гидроксид металла и выделяется водород. Эта реакция происходит со значительным выделением тепла.
Реактивность щелочных металлов с водой зависит от их положения в периодической системе. Литий наиболее реактивен и, при контакте с водой, немедленно начинает гореть и выделяться водород. Калий и натрий также реагируют с водой, но уже не так быстро и интенсивно, как литий.
Реакция щелочных металлов с водой важна с практической точки зрения. Гидроксиды щелочных металлов, образующиеся в результате этой реакции, являются щелочными растворами. Они широко используются в различных областях, включая промышленность, медицину и бытовые нужды.
В заключение следует отметить, что реакция щелочных металлов с водой является одной из основных реакций, характерных для этой группы элементов. Она позволяет получить щелочные растворы и выделять водород, что находит применение в различных областях науки и техники.
Образование гидроксидов при взаимодействии щелочных металлов с водой

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют химическую активность при взаимодействии с водой. Эти металлы образуют гидроксиды, сильные основания, когда вступают в контакт с водой.
Этот процесс является экзотермическим, то есть сопровождается выделением тепла. При взаимодействии щелочного металла с водой происходит реакция, в результате которой образуется гидроксид металла и выделяется водород. Реактивность щелочных металлов возрастает по мере движения вверх по периодической таблице.
Образование гидроксидов при взаимодействии щелочных металлов с водой имеет важное промышленное применение. Гидроксиды щелочных металлов широко используются в процессах очистки воды, при производстве мыла, стекла, щелочных батарей и других химических соединений. Они также являются основными компонентами многих бытовых чистящих средств и моющих средств.
Гидроксиды щелочных металлов обладают щелочными свойствами, то есть они растворяются в воде, образуя щелочные растворы. Щелочные растворы имеют высокий уровень рН и обладают специфическими химическими свойствами. Они широко используются в различных отраслях промышленности, в научных исследованиях и в повседневной жизни.
Характеристика щелочных растворов

Щелочные растворы - это растворы, которые обладают щелочной средой. Они образуются при взаимодействии щелочных металлов с водой, а также при диссоциации щелочных оксидов и щелочных гидроксидов.
Щелочные растворы обладают рядом характеристик, которые отличают их от других растворов. Во-первых, они имеют высокую щелочность, то есть обладают высоким значением pH, которое превышает 7. Это означает, что щелочные растворы содержат большое количество гидроксидных иона, OH-, которые являются основой и принимают протоны от кислотных соединений.
Во-вторых, щелочные растворы обладают способностью отщелачивать, то есть разлагать кислотные вещества, образуя соли и воду в ходе реакции нейтрализации. Эта свойство щелочных растворов широко используется в химической промышленности и быту, например, для удаления кислотных загрязнений или для нейтрализации кислотного pH в воде.
Третья характеристика щелочных растворов - их способность образовывать осадки и отделяться от раствора при введении реагента, изменяющего рН. Данное свойство используется в аналитической химии для определения щелочных металлов в растворах и пробы при помощи прокалывания или осаждения.
В целом, щелочные растворы имеют свои уникальные характеристики, которые определяют их эффективность и широкое применение в различных областях, таких как промышленность, медицина и бытовые нужды.
Практическое применение щелочных растворов

1. Производство моющих средств и бытовой химии.
Щелочные растворы широко применяются в производстве моющих средств и бытовой химии. Они используются для удаления жира и других загрязнений с поверхностей. Например, натр сильнщелочное вещество, используемое для отжиривания посуды и очистки канализационных труб от жирового налета.
2. Реверсивные щелочные аккумуляторные батареи.
Щелочные растворы также применяются в реверсивных щелочных аккумуляторных батареях. Реверсивные батареи могут быть перезаряжаемыми и обратимыми. Щелочные растворы играют важную роль в процессе заряда и разряда таких батарей. Они обеспечивают электролитическую проводимость и позволяют аккумулятору получать и отдавать электрическую энергию.
3. Утилизация отходов.
Щелочные растворы часто используются в процессе утилизации отходов. Например, виниловая пленка, содержащая полихлорированные бифенилы (PCB), может быть обработана в щелочном растворе для удаления опасных веществ и нейтрализации их влияния на окружающую среду.
4. Очистка воды.
Щелочные растворы могут быть использованы для очистки воды от различных загрязнений и примесей. Например, они могут быть использованы для удаления органических и неорганических загрязнений, растворения тяжелых металлов или регулирования уровня pH в воде.
5. Фармацевтическая промышленность.
В фармацевтической промышленности щелочные растворы могут быть использованы для контроля качества и очистки различных медикаментов. Кроме того, они могут служить основой для получения растворимых форм лекарственных веществ.
Вопрос-ответ

Какие металлы образуют щелочные растворы при реакции с водой?
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, при взаимодействии с водой образуют щелочные растворы.
Почему щелочные металлы образуют щелочные растворы при реакции с водой?
Щелочные металлы обладают высокой реакционной способностью и имеют низкую энергию ионизации. При контакте с водой, они образуют гидроксиды, которые являются щелочными растворами.
