Щелочные металлы - натрий, калий, рубидий, цезий - являются самыми активными из всех металлов в периодической системе элементов. Они легко реагируют с водой, кислородом и другими веществами, образуя алкали- и алкалинооземельные гидроксиды. Однако, интересно отметить, что эти металлы не реагируют с растворами солей. Это явление вызывает вопросы и требует объяснения.
При растворении солей, происходит диссоциация ионов в растворе. Катионы соли и анионы сопрягающей кислоты или основания выбивают других катионы и анионы из раствора. Этот принцип называется принципом замещения. Но почему же щелочные металлы не реагируют с такими ионами, как натрий или калий?
Объяснение этого явления связано с высокой активностью щелочных металлов. Они имеют один валентный электрон в своей внешней оболочке, что делает их очень реакционноспособными. Связь между этим электроном и ядром атома очень слабая, что обуславливает легкое отделение электрона и образование положительного иона. Следовательно, при растворении ионов во время диссоциации соли, щелочные металлы уже находятся в ионной форме и, соответственно, не могут замещать другие ионы в растворе.
В конечном итоге, отсутствие реакции щелочных металлов с растворами солей объясняется их безбашенной реакционностью и особенностями строения атома. Это явление имеет широкое применение в химии и используется при разработке различных химических процессов и методов анализа. Понимание механизма этого процесса позволяет более точно предсказывать и планировать реакции металлов с солями и использовать их в нужных химических реакциях.
История открытия

Открытие отсутствия реакции щелочных металлов с растворами солей является важным моментом в развитии химии и было достигнуто благодаря многолетним исследованиям ученых. Химики долго изучали реакции металлов с различными веществами, и, в конце концов, было установлено, что щелочные металлы, такие как натрий и калий, не реагируют с растворами солей.
Первые важные эксперименты на эту тему провел известный химик Гумберто Фоо. В 1865 году он изучил реакцию натрия с раствором хлорида свинца и обнаружил, что никакой реакции не происходит.
Значительный вклад в изучение отсутствия реакции щелочных металлов с растворами солей внесли также ученые Йоханес Брей и Мария Кюри. В своих экспериментах они провели серию титрований, используя щелочные металлы и различные соли. Результаты их исследований показали, что натрий и калий не вызывают никакой видимой реакции при взаимодействии с растворами солей.
Окончательное объяснение отсутствия реакции щелочных металлов с растворами солей было предложено в 1905 году Леонардом Аррениусом. Согласно его теории ионизации, щелочные металлы образуют ионы, но они находятся в таком состоянии, что не вступают в химическую реакцию с ионами солей. Поэтому щелочные металлы не реагируют с растворами солей и не образуют новых соединений.
Химические свойства щелочных металлов

Щелочные металлы являются группой элементов, которые входят в первую группу периодической таблицы. В состав этой группы входят литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают рядом характерных химических свойств, которые объясняются их строением и электронной конфигурацией.
Одним из главных свойств щелочных металлов является их активность в реакциях с водой. При взаимодействии с водой щелочные металлы образуют гидроксиды и высвобождаются молекулы водорода. Эта реакция сопровождается образованием щелочных растворов, которые обладают щелочной средой, т.е. имеют высокую концентрацию гидроксидных ионов.
Ещё одним важным свойством щелочных металлов является их способность образовывать соли. Щелочные металлы реагируют с кислотами, образуя соли и высвобождая молекулы воды. Данная реакция называется нейтрализацией и является основной химической реакцией, которая используется для получения солей, в том числе лечебных и химических соединений.
Также щелочные металлы обладают высокой реакционной способностью в отношении кислорода. При контакте с кислородом они образуют оксиды, которые, в свою очередь, реагируют с водой, образуя основания. Эта реакция, называемая гидролизом, приводит к образованию гидроксидов, которые являются основаниями. Гидроксиды щелочных металлов применяются в производстве щелочей, мыла и щелочных аккумуляторов.
В заключение, химические свойства щелочных металлов включают их активность в реакциях с водой, способность образовывать соли и реакционную способность в отношении кислорода. Эти свойства обусловлены особенностями электронной структуры и взаимодействием элементов с другими веществами. Щелочные металлы играют важную роль в химической промышленности и имеют широкий спектр применения в различных отраслях науки и техники.
Взаимодействие щелочных металлов с водой

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают характерными свойствами взаимодействия с водой. Их взаимодействие с водой является очень активным и может сопровождаться реакцией, называемой гидролизом.
Когда щелочный металл погружается в воду, происходит разрушение связей между атомами металла и образуется положительно заряженный ион металла (катион), а также освобождается водород. Вода играет роль лёгкого растворителя, помогая разлагать металлический элемент на ионы.
Реакция взаимодействия щелочных металлов с водой имеет общий механизм. Когда кусочек металла погружается в воду, происходит окислительно-восстановительное взаимодействие: металл окисляется, а вода восстанавливается. В результате этой реакции образуются ионы металла и молекулы воды, участвующие в реакции гидролиза.
Реакция гидролиза щелочных металлов с водой протекает очень быстро и может сопровождаться выделением большого количества тепла и пузырьков газа. При этом вода может становиться щелочной из-за образования гидроксидов щелочных металлов, которые являются крепкими щелочами и обладают основными свойствами.
Объяснение отсутствия реакции с растворами солей
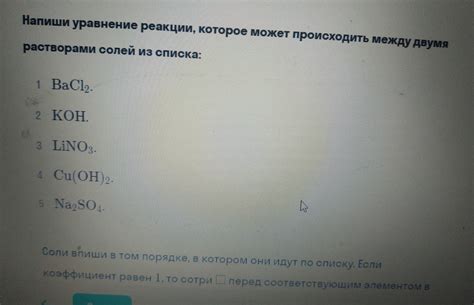
Одной из основных характеристик щелочных металлов является их высокая химическая активность, осуществляемая благодаря наличию одной внешней электронной оболочки. Тем не менее, их реакционная способность может быть частично или полностью подавлена во время контакта с растворами солей.
Отсутствие реакции между щелочными металлами и растворами солей можно объяснить несколькими факторами. Прежде всего, щелочные металлы обладают большой энергией ионизации, что делает их электроотрицательностью ниже, чем у многих других элементов. В результате, они образуют эффективные ионные соединения с положительно заряженными ионами в растворе соли.
Кроме того, щелочные металлы имеют низкую аффинность к кислороду, что ограничивает их способность к вступлению в реакцию с водой, особенно в сравнении с амфотерными металлами, такими как алюминий или цинк.
Дополнительно, реакция между щелочными металлами и растворами солей может быть затруднена из-за образования защитной пленки на поверхности металла. Когда щелочный металл реагирует с водой или раствором, на его поверхности может образоваться окисленный слой, предотвращающий дальнейшее вступление в реакцию соли.
Механизм взаимодействия щелочных металлов с растворами солей

Взаимодействие щелочных металлов с растворами солей основывается на ионной реакции, в результате которой в общем случае происходит осаждение нерастворимых солей. Щелочные металлы, такие как натрий, калий и литий, обладают низкой электроотрицательностью и, следовательно, высокой электрохимической активностью. Поэтому они обладают способностью вытеснять осадки менее активных металлов из растворов ионов, образуя свои собственные нерастворимые соединения.
Механизм взаимодействия щелочных металлов с растворами солей можно представить следующим образом. Вначале ионы щелочного металла образуют комплексы с анионами растворенных солей. Затем происходит постепенное вытеснение менее активных металлов из этих комплексов, так как ионы щелочного металла обладают большей активностью.
При этом образуется осадок нерастворимого соединения щелочного металла, а раствор становится бедным на ионы менее активного металла. Данный механизм взаимодействия объясняет отсутствие реакции щелочных металлов с растворами солей, так как они образуют свои собственные осадки из-за своей высокой активности.
Таким образом, механизм взаимодействия щелочных металлов с растворами солей основан на ионной реакции, при которой щелочные металлы вытесняют менее активные металлы из растворов, образуя свои собственные нерастворимые соединения. Это объясняет наблюдаемое отсутствие реакции между щелочными металлами и растворами солей.
Вопрос-ответ

Почему реакция щелочных металлов с растворами солей не происходит?
Отсутствие реакции щелочных металлов с растворами солей объясняется их высокой активностью. Щелочные металлы, такие как натрий, калий и литий, обладают низкой электроотрицательностью и, следовательно, имеют сильную склонность отдавать электроны другим элементам. В растворе соли, металлы находятся в ионизированном состоянии, образуя катионы. Однако, катионы щелочных металлов уже находятся в самом высоком окислительном состоянии, поэтому они больше не имеют возможности отдавать электроны и вступать в дальнейшие реакции с другими веществами.
Может ли реакция щелочных металлов с растворами солей протекать при определенных условиях?
Хотя реакция щелочных металлов с растворами солей, как правило, не протекает, в некоторых случаях она может происходить при определенных условиях. Например, если добавить к раствору соли такое вещество, которое может вытеснить катионы металла из раствора, такая реакция может происходить. Однако, это скорее исключение, чем правило, и в общем случае щелочные металлы не проявляют реактивности по отношению к растворам солей.
Какие основные факторы влияют на отсутствие реакции щелочных металлов с растворами солей?
Отсутствие реакции щелочных металлов с растворами солей определяется несколькими факторами. Во-первых, это высокая активность щелочных металлов, которая приводит к тому, что они уже находятся в наиболее окисленном состоянии и не имеют возможности отдавать электроны. Во-вторых, структура растворов солей, особенно ионообменная способность, также не способствует реакции с щелочными металлами. Эти факторы в совокупности объясняют, почему реакция между щелочными металлами и растворами солей не происходит.
