Щелочные металлы – это подгруппа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они отличаются высокой реакционной способностью и активностью, особенно в контакте с водой и растворами солей. Реакция щелочных металлов с растворами солей имеет свои особенности и может протекать по нескольким сценариям.
Одной из особенностей реакции щелочных металлов с растворами солей является выделение газа. Например, при реакции натрия с раствором хлорида натрия (NaCl) образуется газообразный хлор (Cl2). Это связано с тем, что щелочные металлы обладают большой аффинностью к кислороду и способны вытеснять другие элементы из их соединений.
Кроме того, реакция щелочных металлов с растворами солей может протекать с образованием осадка. Например, при взаимодействии натрия с раствором сульфата меди (CuSO4) образуется осадок гидроксида меди (Cu(OH)2). Это происходит из-за образования нерастворимого вещества в результате реакции.
Также стоит отметить, что реакция щелочных металлов с растворами солей может иметь взрывоопасный характер. Например, при взаимодействии лития с раствором хлорида свинца (PbCl2) может произойти взрыв. Поэтому при работе с щелочными металлами необходимо соблюдать особую осторожность и применять соответствующие меры безопасности.
Понятие реакции металлов с растворами солей

Реакция металлов с растворами солей является одним из основных процессов в химии и имеет большое практическое значение. Она основана на способности металлов образовывать ионы, взаимодействующие с ионами водорода и сторонними металлами.
Щелочные металлы, такие как натрий, калий и литий, проявляют высокую реакционную способность с растворами солей. Во время реакции ионы щелочных металлов обмениваются с ионами металлов соли, что приводит к образованию ионов щелочных металлов в растворе.
Образование ионов щелочных металлов в растворе сопровождается выделением газа и образованием осадка, что позволяет использовать данную реакцию для идентификации металлов или их расчетного определения.
Примеры реакции щелочных металлов с растворами солей включают образование осадка при смешении растворов натрия и серебра, образование газа при взаимодействии раствора калия и соляной кислоты, а также образование осадка при смешении растворов лития и хлорида свинца.
Реакция металлов с растворами солей является важным инструментом в химическом анализе и имеет множество применений в разных отраслях науки и промышленности.
Реакция щелочных металлов с солями: общие черты
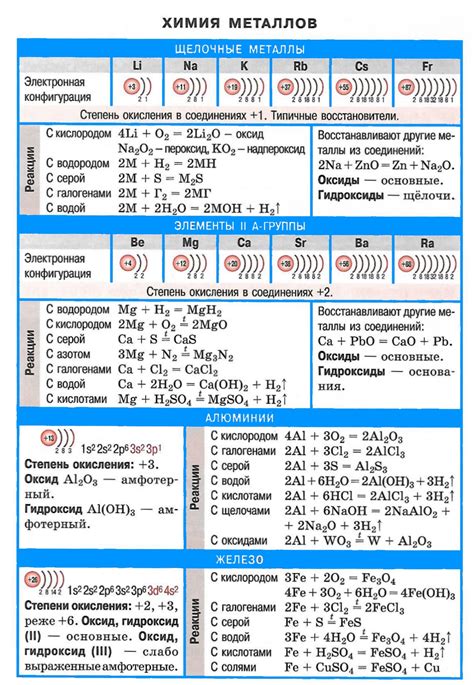
Щелочные металлы, такие как натрий, калий и литий, характеризуются высокой реакционной способностью. Они входят в группу первых элементов в периодической системе и обладают одновалентными ионами. Реакция щелочных металлов с солями обычно проходит с образованием новых веществ и проявлением характерных свойств.
Щелочные металлы реагируют с солями таких элементов, как хлор, бром, йод, сера, фосфор и многие другие. В результате реакции образуются соли соответствующих элементов и обычно обильно выделяются газы, включая газы с характерным запахом.
Реакция щелочных металлов с солями может проходить следующим образом: щелочной металл вытесняет металл из соли, образуя новую соль и свободный металл. Например, натрий реагирует с хлоридом железа, образуя хлорид натрия и обильное выделение железного металла.
Реакции щелочных металлов с солями часто сопровождаются выделением тепла и света. Они происходят очень быстро и с высокой степенью реакционной способности. Мощность реакций также может привести к возникновению пожара или взрыва, поэтому необходимо быть предельно осторожным при проведении таких экспериментов.
Примеры реакций щелочных металлов с солями включают реакцию натрия с хлоридом никеля, приводящую к образованию натрия и хлорида никеля. Еще один пример - реакция калия с хлоридом ртути, при которой образуется хлорид калия и элементарная ртуть.
Реакция натрия с растворами солей: примеры и особенности
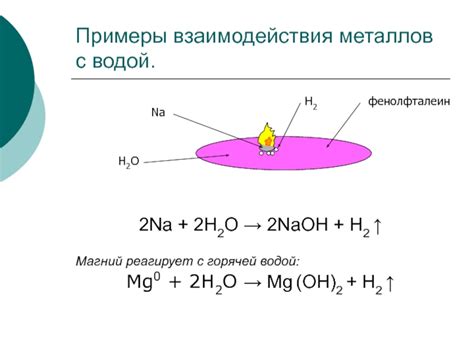
Реакция натрия с растворами солей представляет собой химическое взаимодействие, которое происходит между натрием, одним из щелочных металлов, и солями. Такая реакция характеризуется рядом особенностей и может иметь различные проявления в зависимости от исходных веществ.
Одной из особенностей реакции натрия с растворами солей является ее ярко выраженный экзотермический характер. При соприкосновении натрия с раствором соли происходит выделение тепла и энергии в виде яркого пламени и искр, сопровождающих химическую реакцию.
Примером такой реакции может служить взаимодействие натрия с раствором хлорида натрия (NaCl). При этом происходит образование гидроксида натрия (NaOH) и выделение хлора (Cl2) в газообразной форме:
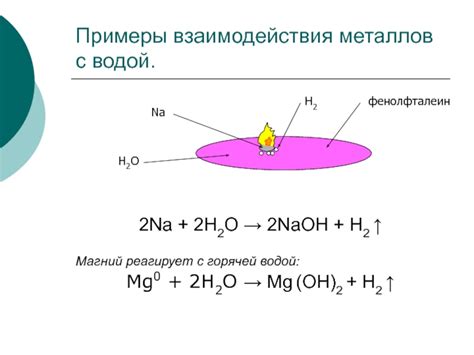
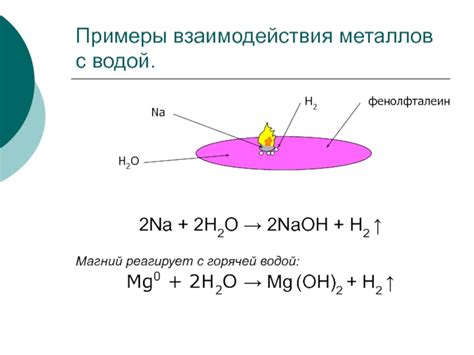
- 2Na + 2H2O → 2NaOH + H2
- 2Na + Cl2 → 2NaCl
Другим примером реакции натрия с солями может быть его взаимодействие с раствором серной кислоты (H2SO4). В результате образуется сера (S) и гидроксид натрия (NaOH):
- 2Na + H2SO4 → Na2SO4 + H2
- 2Na + 2H2O → 2NaOH + H2
Таким образом, реакция натрия с растворами солей является активным и показательным химическим процессом, который может иметь различные проявления в зависимости от веществ, взаимодействующих между собой.
Реакция калия с растворами солей: примеры и особенности
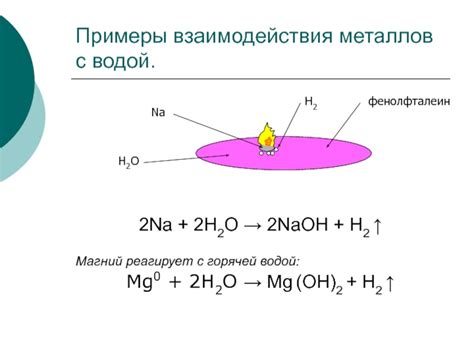
Особенности реакции:
- Калий является щелочным металлом, поэтому его реакция с растворами солей происходит с выделением водорода и образованием гидроксида щелочного металла.
- Реакция калия с растворами солей обычно протекает с выделением большого количества энергии и образованием яркого пламени, что делает ее заметной и эффектной.
- Калий реагирует с растворами солей быстро и интенсивно, поэтому при проведении реакции необходимо соблюдать осторожность, так как это может быть опасно.
Примеры реакции калия с растворами солей:
| Соль | Уравнение реакции |
|---|---|
| Хлорид натрия (NaCl) | 2K + 2NaCl → 2KCl + H2 |
| Сульфат магния (MgSO4) | K2 + MgSO4 → 2K2SO4 + Mg |
| Ацетат свинца (Pb(C2H3O2)2) | 2K + Pb(C2H3O2)2 → 2KC2H3O2 + 2Pb |
Реакция калия с растворами солей представляет собой важное химическое явление, которое может быть использовано в различных областях, включая синтез органических соединений и производство различных химических продуктов.
Реакция лития с растворами солей: примеры и особенности
Литий является активным щелочным металлом и проявляет химическую реакцию с растворами различных солей. Эта реакция обусловлена высокой реакционной способностью и электрохимической активностью лития.
Растворы солей, вступающие в реакцию с литием, могут быть представлены различными катионами, такими как натрий, калий, магний и другие. Например, реакция лития с раствором нитрата натрия (NaNO3) приводит к выделению гидроксида лития (LiOH) и нитрата натрия (NaNO3).
Особенностью реакции лития с растворами солей является выделение гидроксида лития, который обладает щелочными свойствами. Это связано с тем, что литий является щелочным металлом и образует гидроксиды с щелочными свойствами при взаимодействии с водой.
Примером реакции лития с раствором хлорида кальция (CaCl2) является образование гидроксида лития и осадка хлорида кальция.
Также, взаимодействуя с растворами солей, литий может образовывать некоторые специфические соединения. Например, реакция лития с раствором сернокислого натрия (Na2SO4) приводит к образованию гидросульфата лития (LiHSO4).
В реакции лития с растворами солей также может наблюдаться выброс газа, причем его состав может изменяться в зависимости от реагирующих веществ. Например, при взаимодействии лития с раствором хлорида натрия (NaCl) образуется хлористый литий (LiCl) и выделяется хлор.
Реакция рубидия с растворами солей: примеры и особенности

Рубидий - щелочной металл, который обладает химической активностью и способен реагировать с растворами солей. Реакция рубидия с растворами солей имеет свои особенности и может приводить к образованию различных химических соединений. Важно отметить, что реакция рубидия с растворами солей зависит от свойств и состава соли, с которой взаимодействует.
Примером такой реакции может служить реакция рубидия с раствором нитрата рубидия. При взаимодействии рубидия с нитратом рубидия образуется новое соединение - нитрат рубидия. Нитрат рубидия представляет собой бесцветные кристаллы, которые легко растворяются в воде. Это химическое соединение может применяться в различных отраслях промышленности, а также в научных исследованиях.
Еще одним примером реакции рубидия с раствором соли является реакция с хлоридом рубидия. При взаимодействии рубидия с хлоридом рубидия образуется ионное соединение - хлорид рубидия. Хлорид рубидия представляет собой белые кристаллы, которые хорошо растворяются в воде. Это соединение также может иметь применение в различных областях, включая химическую промышленность и лабораторные исследования.
Реакция рубидия с растворами солей может проходить с выделением тепла и газов, что является общей особенностью реакций щелочных металлов с солями. Процессы, связанные с реакцией рубидия с растворами солей, могут быть использованы в различных химических реакциях и синтезе новых соединений.
Реакция цезия с растворами солей: примеры и особенности
Цезий – щелочной металл, обладающий высокой химической реактивностью и интересными свойствами. Его взаимодействие с растворами солей также происходит с образованием характерных соединений и особыми особенностями.
Один из примеров реакции цезия с растворами солей – это сочетание цезия с хлоридом натрия. При смешивании этих реагентов происходит двухэтапная реакция, в результате которой образуется хлорид цезия и нитрат натрия. В ходе этой реакции ион цезия замещает ион натрия в хлориде натрия, а в нитрате натрия возникаet нейтралитет.
Растворимость соединений цезия сильно зависит от природы аниона и условий реакции. Например, цезий-бромид обладает очень высокой растворимостью в воде, поэтому при взаимодействии цезия с бромидом натрия может образоваться модификация этого соединения.
Другим примером реакции цезия с растворами солей является взаимодействие цезия с сульфатом меди. В результате образуется хлорид цезия и осадок гидросульфата цезия. Этот осадок является безцветным соединением и может использоваться в качестве среды для проведения электролиза.
Таким образом, реакция цезия с растворами солей происходит с образованием химических соединений и имеет свои особенности в зависимости от реагентов и условий реакции.
Особенности реакции щелочных металлов с растворами солей

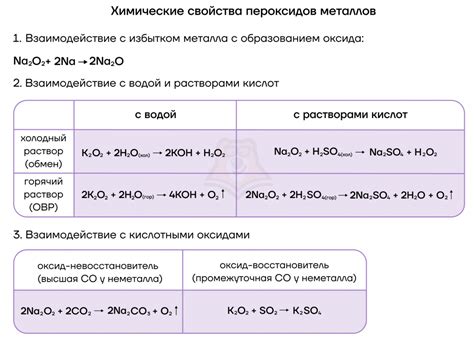
Реакция щелочных металлов с растворами солей является одной из важных химических реакций. Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой химической активностью из-за низкой ионизационной энергии. При контакте с растворами солей происходят различные химические и физические изменения.
Во-первых, щелочные металлы обладают способностью диссоциировать в воде, образуя ионы гидроксида. Это особенно типично для натрия и калия. Реакция протекает с выделением тепла и образованием щелочного раствора. Гидроксиды щелочных металлов являются сильными основаниями и обладают выраженной щелочностью.
Во-вторых, реакция щелочных металлов с растворами солей может приводить к образованию осадков. Например, при взаимодействии натрия или калия с раствором соли другого металла, может происходить образование нерастворимых осадков соответствующих гидроксидов или карбонатов. Это может быть использовано для разделения металлов и очистки растворов от необходимых примесей.
Кроме того, реакция щелочных металлов с растворами солей может приводить к образованию газов. Например, при контакте натрия или калия с растворами солей некоторых кислот, таких как соляная или серная кислота, выделяется соответствующий газ (хлороводород или сероводород). Это особенно важно для обнаружения и идентификации солей и кислотных соединений.
Таким образом, процесс реакции щелочных металлов с растворами солей включает несколько особенностей, таких как диссоциация в воде, образование осадков и выделение газов. Эти особенности имеют практическое применение в различных областях химии и могут быть использованы для разделения, очистки и идентификации различных веществ.
Примеры реакций щелочных металлов с растворами солей в жизни

Реакция щелочных металлов с растворами солей может наблюдаться в различных сферах нашей жизни. Например, в области пищевой промышленности щелочные металлы, такие как натрий и калий, используются для нейтрализации кислого вкуса в некоторых продуктах, таких как газированные напитки. Когда щелочный металл реагирует с раствором кислоты, образуется соль и вода, что позволяет снизить кислотность и сделать продукт более приятным для потребления.
Другим примером может быть использование натрия или калия для очистки воды в бассейнах и аквариумах. Растворы солей, такие как хлорид натрия или хлорид калия, могут быть добавлены в воду, чтобы предотвратить размножение бактерий и микроорганизмов. Это особенно важно для обеспечения безопасности плавания и ухода за рыбами в аквариумах.
Одним из наиболее известных примеров реакции щелочных металлов с растворами солей является образование осадка при взаимодействии хлорида натрия с раствором серебряной нитратной кислоты. При смешивании этих растворов образуется мутная белая осадок в форме хлорида серебра - AgCl. Это свойство используется в химических экспериментах, таких как определение наличия хлоридов в растворе с помощью аналитической химии.
Еще одним примером реакции щелочных металлов с растворами солей является образование газа при взаимодействии натрия или калия с раствором сульфата. Например, при смешивании натрия и сульфата свинца, образуется газ сернистого ангидрида - SO2. Этот газ может использоваться в различных отраслях промышленности, например, в процессе производства бумаги или винтажных фотографий.
Вопрос-ответ

Какие особенности реакции щелочных металлов с растворами солей?
Особенности реакции щелочных металлов с растворами солей заключаются в образовании осадков и выделении газов. В результате реакции, могут образовываться осадки, такие как гидроксиды щелочных металлов, особенно если в растворе солей присутствуют анионы, которые могут образовывать нерастворимые соединения с щелочными металлами. Кроме того, в процессе реакции могут выделяться газы, например, при взаимодействии щелочного металла с солями кислот образуется соответствующее солевое основание и выделяется вода.
Какие примеры реакций щелочных металлов с растворами солей можно привести?
Примеры реакций щелочных металлов с растворами солей включают реакцию натрия с хлоридом железа(III), в результате которой образуется нерастворимый гидроксид железа(III) и хлорид натрия. Ещё одним примером является реакция калия с нитратом свинца(II), в результате которой образуются нитрат калия и нерастворимый осадок гидроксида свинца(II).