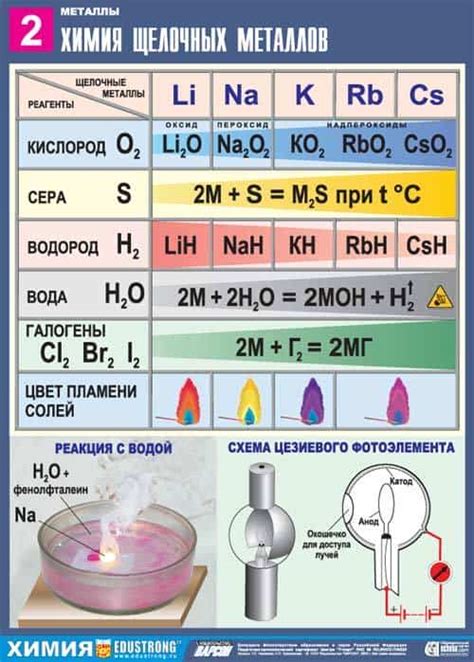
Щелочные металлы, такие как литий, натрий и калий, известны своей активностью и реакционностью с неметаллами. Эти металлы обладают одной валентностью и, поэтому, могут образовывать соединения с различными функциональными группами.
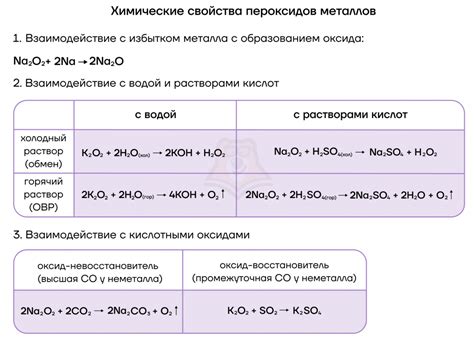
Одним из наиболее распространенных примеров реакции щелочных металлов с неметаллами является их реакция с кислородом. Щелочные металлы образуют кислородные соли, называемые оксидами. Например, реакция лития с кислородом приводит к образованию лития оксида (Li2O), а реакция натрия с кислородом приводит к образованию натрия оксида (Na2O).
Кроме того, щелочные металлы реагируют с халогенами, такими как хлор, бром и йод. Реакция этих металлов с хлором приводит к образованию металлических хлоридов. Например, реакция лития с хлором приводит к образованию лития хлорида (LiCl), а реакция натрия с хлором приводит к образованию натрия хлорида (NaCl).
Более сложные реакции возникают при взаимодействии щелочных металлов с неметаллическими элементами из других функциональных групп. Например, реакция натрия с серой приводит к образованию натрия сульфида (Na2S), а реакция натрия с фосфором приводит к образованию натрия фосфида (Na3P).
Таким образом, реакция щелочных металлов с неметаллами является важной и широко изучаемой областью химии. Взаимодействие этих металлов с различными функциональными группами ненеталлических соединений позволяет получать разнообразные химические соединения с уникальными свойствами и применениями.
Вводная информация

Щелочные металлы (натрий, калий, рубидий, цезий) обладают высокой реакционной способностью и легко взаимодействуют с различными неметаллами. Взаимодействие щелочных металлов с неметаллами можно описать как передачу электронов от металла к неметаллу, что приводит к образованию ионов обоих веществ.
Реакции щелочных металлов с неметаллами приводят к образованию различных соединений, таких как соли, оксиды, гидриды и другие. Эти соединения могут иметь различные функциональные группы, которые определяют их свойства и реакционную способность.
В ходе взаимодействия щелочных металлов с неметаллами происходит образование ионов, что связано с изменением зарядов на атомах. Например, при реакции натрия с хлором образуются ионы Na+ и Cl-, что приводит к образованию хлорида натрия – основного соединения натрия с хлором. В зависимости от вещества, с которым реагирует щелочный металл, образуются различные соединения самих металлов или соли.
Реакция щелочных металлов с галогенами
Щелочные металлы, такие как натрий, калий и литий, обладают свойством образовывать соединения с различными неметаллами. Одной из наиболее характерных реакций является реакция щелочных металлов с галогенами.
Галогены – это группа химических элементов, включающая фтор, хлор, бром и йод. В результате реакции щелочного металла с галогеном образуется соединение, которое имеет ионную структуру и является солью. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl).
Реакция между щелочными металлами и галогенами обычно протекает с высокой степенью энергии и сопровождается выделением тепла и света. Такие реакции относятся к экзотермическим реакциям.
Соединения, образованные в результате реакции щелочных металлов с галогенами, обладают рядом важных свойств. Например, хлориды щелочных металлов широко используются в пищевой промышленности и медицине для соления и дезинфекции.
Итак, реакция щелочных металлов с галогенами представляет собой интересный и практически значимый химический процесс, который приводит к образованию солей щелочных металлов.
Реакция щелочных металлов с кислородом
Реакция щелочных металлов с кислородом является характерной и обладает своими особенностями. При контакте щелочного металла с кислородом происходит горение, сопровождающееся выделением яркого пламени и образованием окислов. Данный процесс обусловлен химической активностью щелочных металлов и их способностью образовывать стабильные оксиды с кислородом.
Реакция щелочных металлов с кислородом протекает по следующей схеме: щелочной металл взаимодействует с молекулами кислорода, что приводит к образованию алкалиновых оксидов. Например, натрий при взаимодействии с кислородом образует оксид натрия (Na2O), а калий - оксид калия (K2O).
Полученные алкалиновые оксиды обладают определенными химическими свойствами и широко используются в разных отраслях промышленности. Например, оксид натрия (Na2O), известный также как натрон, применяется в стекольной промышленности для производства стекла. Также алкалиновые оксиды используются в качестве ионных средств при проведении некоторых химических реакций и в качестве компонентов для изготовления гидроксидов щелочных металлов.
Реакция щелочных металлов с кислородом является важным процессом с точки зрения промышленности и научных исследований. Она имеет множество приложений и помогает в разработке новых материалов и технологических процессов. Поэтому, изучение данной реакции является актуальной и интересной задачей для химиков и научных работников.
Реакция щелочных металлов с серой

Сера является одним из важнейших неметаллов и может реагировать с щелочными металлами, такими как литий, натрий, калий, чтобы образовать соединения.
В реакции серы с щелочными металлами образуется сульфид натрия, сульфид калия и соответствующие соединения с другими щелочными металлами. Сульфиды щелочных металлов обладают характерным запахом и обычно представляют собой кристаллические вещества желтого или белого цвета.
Реакция щелочных металлов с серой происходит с выделением тепла. При этом сера окисляется, а металлы восстанавливаются. Сера может быть использована в реакции с щелочными металлами для получения соответствующих сульфидов, которые находят применение в различных областях, включая производство стекла, керамики и косметической промышленности.
Кроме того, щелочные металлы могут образовывать растворимые соединения с серой, такие как сульфаты. Сульфаты щелочных металлов являются важными химическими соединениями и находят широкое применение в производстве удобрений, моющих средств и лекарственных препаратов.
Реакция щелочных металлов с фосфором

Реакция щелочных металлов с фосфором – это одна из химических реакций, которая происходит, когда щелочный металл (например, натрий, калий или литий) вступает в контакт с фосфором. При этом образуется соединение, известное как фосфид металла.
В данной реакции металлы обычно выступают в роли окислителей, тогда как фосфор действует как восстановитель. Щелочные металлы обладают высокой электроотрицательностью, что позволяет им легко отдавать электроны. Фосфор, с другой стороны, имеет сравнительно низкую электроотрицательность, поэтому он может принять электроны.
Реакция между щелочными металлами и фосфором может протекать с различной интенсивностью в зависимости от условий проведения. В некоторых случаях реакция может приводить к выделению газа или изменению внешнего вида образовавшегося соединения. Однако при правильной стехиометрии и соблюдении условий проведения реакция щелочных металлов с фосфором обычно протекает без особых проявлений.
Известно также, что реакция щелочных металлов с фосфором может протекать с образованием различных фосфидных структур, в которых металл и фосфор соединяются в определенном соотношении. Например, существуют монофосфиды, дифосфиды и трехфосфиды, которые образуются в зависимости от количества исходных веществ.
Реакция щелочных металлов с азотом

Реакция щелочных металлов с азотом довольно интенсивная и является одним из способов получения азидов. Щелочные металлы, такие как натрий, калий и другие, могут взаимодействовать с азотом при высоких температурах и/или в присутствии катализаторов.
В результате реакции образуются азиды щелочных металлов, которые являются соединениями с высоким содержанием азота. Азиды обладают различными свойствами и широко используются в химической и фармацевтической промышленности.
Реакция щелочных металлов с азотом может протекать как в газовой фазе, так и в жидкой или твердой среде. В газовой фазе щелочные металлы и азот вступают в прямое взаимодействие, образуя азиды с выделением энергии и образованием остатка кислорода. В жидкой или твердой среде реакция может протекать более медленно и требовать применения специальных условий, таких как внесение вещества-катализатора или повышение температуры.
Реакция щелочных металлов с азотом имеет большое значение в химической промышленности, так как азиды используются в качестве взрывчатых веществ, катализаторов и компонентов для производства различных соединений. Также, реакция является одним из методов получения азота в чистом виде и находит применение в научных исследованиях.
Реакция щелочных металлов с углеродом

Реакция щелочных металлов с углеродом является одной из важных химических реакций, которая имеет много применений в различных областях науки и промышленности. Щелочные металлы, такие как натрий, калий и цезий, обладают высокой активностью и способностью образовывать ионные соединения.
Реакция щелочных металлов с углеродом происходит при нагревании щелочного металла с углем до высоких температур. При этом происходит образование карбидов щелочного металла, которые являются соединениями углерода и металла.
Карбиды щелочных металлов имеют множество применений. Они используются как материалы для производства твердых сплавов, катализаторов, а также в производстве взрывчатых веществ и полупроводников. Карбиды имеют высокую прочность и твердость, что делает их очень полезными в различных индустриальных процессах.
Например, реакция натрия с углем приводит к образованию натриевого карбида (Na2C2), который широко используется в производстве ацетилена и других органических соединений. Карбиды щелочных металлов также являются важными компонентами в производстве пластмасс, резиновых изделий и других полимерных материалов.
Вопрос-ответ

Какие различия в реакции щелочных металлов с неметаллами могут быть?
Реакция щелочных металлов с неметаллами может происходить по-разному. Например, соединения кислорода и серы с щелочными металлами образуют оксиды и сульфаты, соответственно. С неметаллами такими как фосфор, щелочные металлы образуют фосфаты. Реакция с галогенами может привести к образованию галогенидов щелочных металлов.
Какие свойства щелочных металлов определяют их реакцию с неметаллами?
Щелочные металлы обладают такими свойствами, как большая активность и низкая электроотрицательность. Именно эти факторы определяют их реакцию с неметаллами. Большая активность щелочных металлов позволяет им образовывать соединения с различными неметаллами, а низкая электроотрицательность способствует образованию ионов металла во время реакции.
