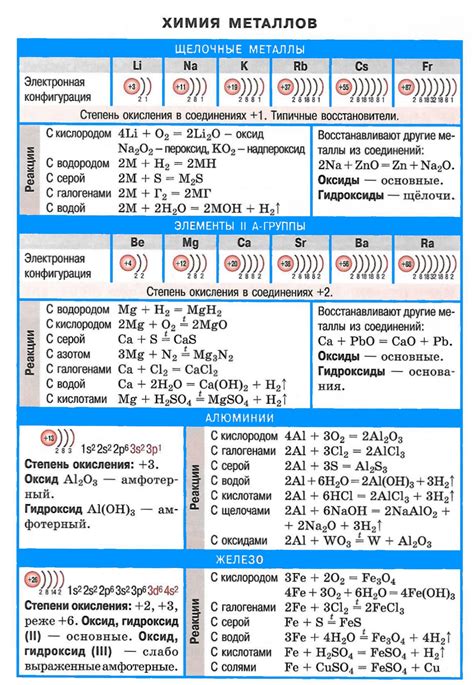
Щелочные металлы, такие как литий, натрий, калий и т.д., имеют высокую активность и легко реагируют с различными элементами, в том числе с неметаллами. Такие реакции могут иметь как положительную, так и отрицательную степень окисления. Сочетания щелочных металлов с неметаллами приводят к образованию солей, оксидов, а также других соединений.
Одним из наиболее известных сочетаний щелочных металлов с неметаллами является их реакция с кислородом. В результате таких реакций образуются оксиды щелочных металлов, которые обладают щелочными свойствами и служат основой для дальнейших реакций. Например, когда металл натрий реагирует с кислородом, образуется оксид натрия (Na2O).
Кроме того, щелочные металлы реагируют с другими неметаллами, такими как хлор, бром и йод. Реакции этих элементов приводят к образованию соответствующих солей металлов, которые имеют важное значение в различных областях науки и промышленности. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl), который широко используется в пищевой промышленности и в химической промышленности для получения различных соединений.
Также щелочные металлы могут реагировать с серой, фосфором и другими неметаллами. При этом образуются соответствующие соли или неорганические соединения, которые имеют различные искомые свойства. Например, реакция натрия с серой приводит к образованию сульфида натрия (Na2S), который применяется в качестве полезных химических соединений в различных отраслях промышленности.
Сочетания щелочных металлов с неметаллами
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), проявляют химическую активность при взаимодействии с неметаллами. Реакции, которые возникают при их сочетании с неметаллами, могут быть различными и иметь как положительный, так и отрицательный эффект.
Одним из наиболее распространенных сочетаний щелочных металлов с неметаллами является их реакция с кислородом (O). В результате образуется оксид, например, оксид лития (Li₂O), оксид натрия (Na₂O) или оксид калия (K₂O). Эти соединения применяются в различных областях, таких как производство стекла или керамики.
Щелочные металлы также могут реагировать с халогенами, такими как фтор (F), хлор (Cl), бром (Br) и йод (I). Образуются соли, например, хлорид лития (LiCl), бромид натрия (NaBr) или йодид калия (KI). Эти соединения широко используются в пищевой промышленности, медицине и других отраслях.
Другим важным сочетанием щелочных металлов с неметаллами является их реакция с серой (S). В результате образуются сульфиды, такие как сульфид лития (Li₂S), сульфид натрия (Na₂S) или сульфид калия (K₂S). Эти соединения применяются в батарейках и аккумуляторах.
Известны также реакции щелочных металлов с азотом (N), аммиаком (NH₃) и многими другими неметаллами. В результате этих сочетаний образуются соединения, которые можно использовать в различных сферах деятельности человека.
Реакции щелочных металлов с кислородом
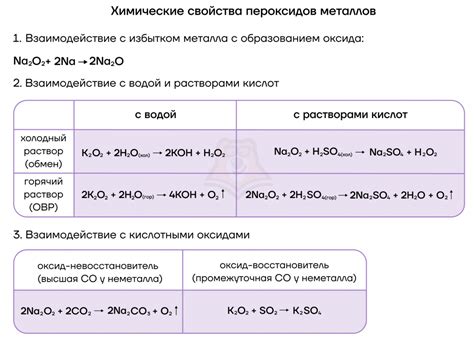
Щелочные металлы, такие как натрий, калий и литий, проявляют высокую реакционную активность при взаимодействии с кислородом.
Когда щелочные металлы источают в кислородной среде, они претерпевают набор химических реакций.
Во время реакции с кислородом интерметаллические соединения образуются между щелочными металлами и кислородом. Эти соединения могут быть оксидами или гидроксидами. Например, натрий образует оксид натрия (Na2O) и гидроксид натрия (NaOH).
Реакция щелочных металлов с кислородом не только проявляется в образовании соединений, но также сопровождается выделением значительного количества энергии. Поэтому эти реакции могут протекать с вспышкой и горением.
Кроме того, реакции щелочных металлов с кислородом являются экзотермическими, то есть сопровождаются выделением тепла. Именно благодаря этому щелочные металлы обладают способностью легко гореть и использоваться в пиротехнике и ракетостроении.
Взаимодействие щелочных металлов с водородом

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., способны реагировать с водородом (H2) и образовывать гидриды. Эти реакции происходят при нагревании металлов с водородом или при пропускании водорода через расплавленный металл.
В результате реакции щелочных металлов с водородом образуются щелочные металлические гидриды, которые являются сильными восстановителями и могут использоваться в различных химических процессах. Гидриды щелочных металлов обладают свойствами хороших источников водорода, который можно использовать в качестве топлива или водородных хранителей.
Реакция между щелочными металлами и водородом является экзотермической реакцией, то есть сопровождается выделением тепла. Это может привести к возгоранию взаимодействующих веществ, поэтому при проведении таких реакций необходимо соблюдать осторожность и принимать меры безопасности.
Взаимодействие щелочных металлов с водородом можно представить следующей схемой реакции:
| Щелочный металл | Реакция с водородом | Образовавшийся гидрид |
|---|---|---|
| Литий (Li) | 2Li + H2 → 2LiH | Литиевый гидрид (LiH) |
| Натрий (Na) | 2Na + H2 → 2NaH | Натриевый гидрид (NaH) |
| Калий (K) | 2K + H2 → 2KH | Калиевый гидрид (KH) |
Реакция щелочных металлов с водородом представляет большой интерес для научных и промышленных исследований, так как позволяет получать и использовать водород в различных процессах, связанных с энергетикой, экологией и другими областями применения.
Реактивность щелочных металлов с галогенами

Щелочные металлы (натрий, калий, рубидий, цезий) обладают высокой реактивностью в реакциях с галогенами (фтор, хлор, бром, йод). При контакте с галогенами, они проявляются как натрий, так и калий, которые крутятся в воздухе с пламенем, а цезий в конечном итоге оказывается способным воспламеняться.
Реакция щелочных металлов с галогенами обычно происходит с образованием солей. Например, натрий реагирует с хлором, образуя хлорид натрия (NaCl). Калий реагирует с бромом, образуя бромид калия (KBr). Реакция калия с йодом приводит к образованию йодида калия (KI).
Иногда реакция между щелочным металлом и галогеном происходит с образованием соединений, в которых группа атомов галогена связана с двумя атомами металла. Например, реакция рубидия с хлором приводит к образованию рубидия хлорид четырехатомного катиона (RbCl2), а реакция цезия с бромом приводит к появлению цезия бромид двухатомного катиона (CsBr2).
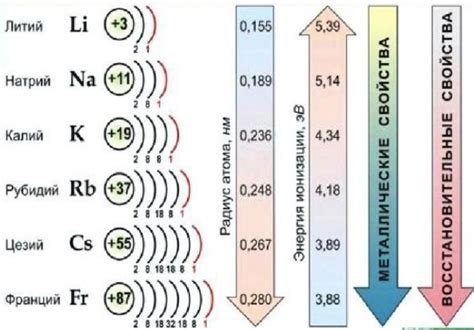
Реактивность щелочных металлов с галогенами увеличивается от верхушки таблицы к основанию. Это объясняется тем, что с увеличением атомного радиуса и уменьшением энергии ионизации увеличивается активность металлов в реакциях. Например, натрий более активен в реакции с хлором, чем калий, а калий — более активный в реакции с хлором, чем рубидий или цезий.
Взаимодействие щелочных металлов с серой и фосфором
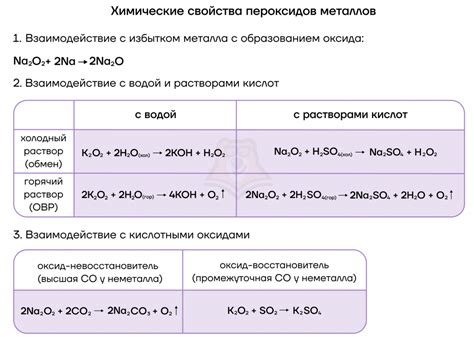
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, могут реагировать с серой и фосфором, образуя различные соединения. Эти реакции являются химическими процессами, при которых происходит обмен электронами между атомами металла и неметалла.
Серия щелочных металлов реагирует с серой и образует сульфиды. Например, реакция натрия с серой приводит к образованию натрия сульфида (Na2S). Сульфиды щелочных металлов обладают высокой растворимостью в воде и являются хорошими проводниками электричества.
Также щелочные металлы могут реагировать с фосфором и образовывать фосфиды. Например, при взаимодействии калия с фосфором образуется калийфосфид (K3P). Фосфиды щелочных металлов также обладают различными свойствами в зависимости от конкретного соединения.
Реакция щелочных металлов с серой и фосфором является одной из основных сочетаний в химии и имеет широкое применение как в лабораторных исследованиях, так и в промышленности. Знание этих реакций важно не только для химиков, но и для всех, кто интересуется наукой и технологией.
Вопрос-ответ

С какими неметаллами реагируют щелочные металлы?
Щелочные металлы (натрий, калий, рубидий, цезий) реагируют с неметаллами, такими как хлор, бром, йод, фтор и сера.
Какие сочетания наблюдаются при реакции щелочных металлов с неметаллами?
При реакции щелочных металлов с неметаллами образуются основные соединения. Например, натрий реагирует с хлором и образует хлорид натрия, NaCl. А калий реагирует с фтором и образует фторид калия, KF.
Насколько сильные реакции происходят при взаимодействии щелочных металлов с неметаллами?
Реакции щелочных металлов с неметаллами обычно проходят довольно сильно. Например, реакция натрия с водородом или кислородом происходит с выделением яркой пламени. Однако реакция калия с кислородом может возгоняться до самовозгорания калия. Поэтому такие реакции требуют осторожности и специальных условий.