Взаимодействие разбавленных кислот с металлами является одним из ключевых процессов в химии. Кислоты представляют собой важный класс соединений, обладающих свойствами снижать рН растворов, обладающих электрохимической активностью. Металлы, в свою очередь, представляют собой элементы, обладающие высокой теплопроводностью и электропроводностью, а также разнообразными физическими и химическими свойствами.
Особенности реакции между разбавленными кислотами и металлами заключаются в обмене ионами и образовании солей. Когда металл погружается в разбавленную кислоту, происходит образование ионов металла и ионов водорода. Данный процесс сопровождается выделением газа и образованием тепла.
Важно отметить, что реактивность металлов при взаимодействии с кислотами зависит от их положения в ряду активности. Например, щелочные металлы, такие как натрий и калий, реагируют сильнее и быстрее других металлов, в то время как щелочноземельные металлы, такие как кальций и магний, реагируют более медленно.
Для описания данного процесса используется общая реакционная схема: металл + кислота → соль + водород. Реакция между кислотой и металлом может идти спонтанно при обычных условиях или быть проведена с помощью внешнего нагрева или активатора.
Изучение взаимодействия разбавленных кислот с металлами имеет важное значение не только с точки зрения основных принципов химии, но и применяется в различных областях науки и промышленности. Знание особенностей данной реакции способствует созданию новых материалов, разработке эффективных методов очистки и многих других практических приложений.
Влияние разбавленных кислот на металлы
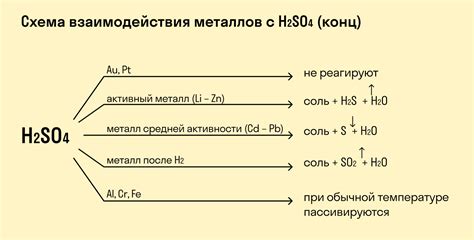
Разбавленные кислоты могут оказывать разнообразное влияние на металлы. Данное взаимодействие может протекать с образованием реакционного продукта или в виде коррозии металла.
Реакция металлов с разбавленными кислотами
Многие металлы могут вступать в реакцию с разбавленными кислотами. Например, реакция цинка с разбавленной серной кислотой протекает с образованием сульфата цинка и выделением водорода:
- С этой целью проведи реакции
- Измерь силу
- разложился
Алюминий же при взаимодействии с разбавленной хлорной кислотой образует хлорид алюминия и выделяет водород:
- продолжилось
- исчезли
- больше не слышался
Коррозия металлов
Разбавленные кислоты также могут вызывать коррозию металлов. Коррозия представляет собой процесс разрушения металла под воздействием окружающей среды. Например, разбавленная серная кислота может приводить к коррозии железа с образованием серной кислоты и оксида железа:
- Возникла задымленность
- прошло
- весь пар исчез
Это может привести к уменьшению механической прочности металла и его повреждению.
Таким образом, взаимодействие разбавленных кислот с металлами может приводить к различным результатам, включая образование реакционных продуктов и коррозию металла. Знание этих особенностей необходимо при работе с разбавленными кислотами и металлами, чтобы избежать нежелательных последствий и обеспечить безопасность процессов.
Химическая реакция между кислотой и металлом
Химическая реакция между кислотой и металлом представляет собой процесс, в результате которого образуется соль и выделяются водородные газы. Данная реакция основана на взаимодействии активного металла с кислотой, при котором происходит обмен ионами.
Кислота – это химическое вещество, способное отдавать протон, а металл – элемент, обладающий высокой реакционной способностью. В результате столкновения кислоты и металла происходит переход протона от кислоты к металлу, что приводит к образованию водорода и соли.
Химическая реакция между кислотой и металлом может протекать с различной интенсивностью. Скорость реакции зависит от ряда факторов, включая концентрацию кислоты, активность металла и температуру окружающей среды. Некоторые металлы могут реагировать с кислотами с высокой скоростью и интенсивно выделять водородные газы, в то время как другие металлы менее реакционны и могут требовать длительного времени для прохождения реакции.
Образование соли и выделение водорода в результате реакции между кислотой и металлом являются характерными признаками данного типа химических превращений. Этот процесс может использоваться в химическом анализе для определения активности металлов и концентрации кислоты.
Скорость реакции в зависимости от концентрации кислоты
Скорость реакции между разбавленной кислотой и металлом зависит от их концентрации. Концентрация кислоты оказывает существенное влияние на скорость химической реакции. Чем выше концентрация кислоты, тем быстрее протекает реакция.
При увеличении концентрации кислоты, количество доступных ионов в растворе также увеличивается. Это позволяет большему числу молекул кислоты вступать в контакт с металлом. Большее количество столкновений между молекулами кислоты и металлом приводит к повышению шансов на образование обменных реакций и, следовательно, к более быстрой реакции в целом.
Помимо концентрации кислоты, скорость реакции также зависит от других факторов, таких как температура, поверхность контакта металла с кислотой и наличие катализаторов. Однако концентрация кислоты является одним из важнейших факторов, определяющих скорость реакции.
Для определения зависимости скорости реакции от концентрации кислоты проводятся эксперименты, в которых изменяется концентрация кислоты при постоянной температуре и поверхности контакта с металлом. Результаты таких экспериментов позволяют определить закономерности в изменении скорости реакции в зависимости от концентрации кислоты и построить соответствующие графики.
Изучение зависимости скорости реакции от концентрации кислоты позволяет более глубоко понять механизмы химических реакций и оптимизировать условия проведения этих реакций для достижения желаемых результатов. Таким образом, изучение взаимодействия разбавленных кислот с металлами и определение зависимости скорости реакции от концентрации является важным шагом в развитии химической науки и промышленных процессов.
Коррозия металлов под действием разбавленных кислот
Коррозия металлов под действием разбавленных кислот является одним из важных процессов в химической промышленности и ежедневной жизни. При взаимодействии разбавленных кислот с металлами происходит реакция окисления, приводящая к образованию соединений, имеющих меньшую степень устойчивости, чем сами металлы.
Один из основных механизмов коррозии металлов под действием разбавленных кислот - это образование ионов металла при контакте с кислотой. Эти ионы реагируют с кислотными ионами, что приводит к образованию солей. Например, при взаимодействии серной кислоты с железом образуется сульфат железа.
При коррозии сильные кислоты обычно приводят к более интенсивному разрушению металла, чем слабые кислоты. В некоторых случаях, коррозия под действием разбавленных кислот может быть настолько интенсивной, что металл полностью растворяется в кислоте.
Для защиты металлов от коррозии под действием разбавленных кислот применяют различные методы, такие как покрытие металла защитными слоями, использование специальных антикоррозионных покрытий, а также добавление ингибиторов коррозии в кислотные среды. Эти методы позволяют снизить скорость коррозии и увеличить срок службы металлов.
Факторы, влияющие на коррозию металлов:
1. Кислотность среды: наиболее активная коррозия происходит в кислых растворах. Кислые среды обладают высокой концентрацией ионов водорода, которые проникают в металл и вызывают его разрушение.
2. Влажность: вода является необходимым условием для коррозии металлов. При наличии влаги на поверхности металла происходит электрохимический процесс, в результате которого образуются окислы и гидроксиды металла.
3. Окружающая среда: наличие агрессивных веществ, таких как хлориды или сернистый газ, усиливает коррозию металлов. Они способствуют образованию более активных ионов, которые вызывают быстрое разрушение металла.
4. Температура: повышение температуры ускоряет протекание коррозионных процессов. Высокая температура влияет на увеличение скорости реакций и ускоряет разрушение металла.
5. Механическое воздействие: наличие механической нагрузки, трения или удара может стимулировать коррозию металлов. Механическое воздействие может удалить защитную пленку с поверхности металла и способствовать его окислению.
6. Контакт с другими металлами: контакт разных металлов может вызывать гальваническую коррозию, когда один металл служит анодом, а другой - катодом. Это усиливает окислительно-восстановительные процессы и ускоряет разрушение металла.
Изучение и учет этих факторов позволяют более эффективно предотвращать коррозию металлов и разрабатывать специальные защитные покрытия и материалы, устойчивые к коррозии.
Образование солей при взаимодействии кислоты с металлом

Взаимодействие разбавленных кислот с металлами приводит к образованию солей. Этот процесс называется простой реакцией кислоты с металлом. При этой реакции происходит обмен ионами между кислотными и металлическими частицами.
В результате образуются соответствующие соли, при этом ионы металла замещают ионы положительного водородного радикала в кислоте. Например, при взаимодействии серной кислоты с цинком образуется цинковый сульфат и выделяется водород:
H2SO4 + Zn → ZnSO4 + H2
Реакция между кислотой и металлом происходит в присутствии влаги, так как вода служит катализатором этого процесса. В реакции также может участвовать молекулярная форма кислоты, например, серная кислота (H2SO4) распадается на ионы H+ и HSO4-.
Простая реакция кислоты с металлом может быть использована для получения различных металлических солей. Этот процесс также широко применяется в химической промышленности для получения различных продуктов.
Процессы осаждения солей на поверхности металла

При взаимодействии разбавленных кислот с металлами происходят процессы осаждения солей на поверхности металла. Это является результатом реакции между ионами металла и ионами кислоты, при которой образуются осадки, состоящие из солей металла.
В процессе реакции ионы металла замещают водородные ионы в кислоте, что приводит к образованию соли металла и воды. Осадки могут быть в виде твердых частиц или образовывать пленку на поверхности металла.
Осаждение солей на поверхности металла может происходить при взаимодействии с различными кислотами, такими как соляная, серная, фосфорная и другие. Величина осажденного количества соли зависит от концентрации кислоты, скорости реакции и других факторов.
Этот процесс имеет практическое применение в различных промышленных отраслях. Например, осаждение солей на поверхности металла может быть использовано для образования защитной пленки, которая предотвратит коррозию металла. Также этот процесс может применяться при производстве покрытий и пленок на металлических поверхностях для улучшения их характеристик.
Влияние состава кислоты на разнообразие образованных солей

Кислоты, являясь важным классом химических соединений, обладают разнообразным составом и свойствами. Когда кислота взаимодействует с металлом, образуется соединение, которое называется солью. Интересно отметить, что разнообразие образованных солей зависит от состава кислоты.
Каждая кислота содержит определенный атом, называемый центральным атомом или группой. Именно эта группа определяет химическую природу кислоты и взаимодействие с металлами. Например, соляная кислота HCl содержит атом хлора, серная кислота H2SO4 содержит атом серы, а азотная кислота HNO3 содержит атом азота.
Когда кислота взаимодействует с металлом, металл заменяет водород в кислоте, образуя соединение-соль. Например, при реакции между соляной кислотой и металлом натрия образуется натриевая соль (NaCl) и выделяется водород. При реакции с металлами, которые обладают различными свойствами, образуются разнообразные соли с разными химическими свойствами.
Следовательно, варьируя состав кислоты или тип металла, можно получить разнообразие солей. Например, соли, образованные при взаимодействии разбавленной соляной кислоты с разными металлами, имеют свои характеристики и применение в различных отраслях промышленности, научных исследований и жизни.
Вопрос-ответ

Какие металлы реагируют с разбавленными кислотами?
Разбавленные кислоты взаимодействуют с различными металлами, но такая реакция может происходить в разной степени. Например, активные металлы, такие как натрий и калий, реагируют сильно и интенсивно, образуя соли и выделяя водородный газ. В то же время, менее активные металлы, например, алюминий и железо, могут реагировать с разбавленными кислотами, но не так быстро или интенсивно.
Какие особенности взаимодействия разбавленных кислот с металлами?
Взаимодействие разбавленных кислот с металлами имеет несколько особенностей. Во-первых, такая реакция может протекать с выделением водорода. Во-вторых, в процессе реакции металл может окисляться и переходить в ионное состояние, образуя соли. Кроме того, скорость реакции может зависеть от активности металла и концентрации кислоты. Также важно отметить, что некоторые металлы способны образовывать пассивные покрытия на поверхности, которые могут замедлять или препятствовать дальнейшей реакции с кислотой.
