Серная кислота, или H2SO4, является одним из наиболее распространенных и важных химических веществ. Она обладает высокой степенью растворимости в воде и может образовывать различные концентрации при разбавлении. Разбавленная серная кислота имеет ряд интересных химических свойств, включая реакцию с металлами ряда.
Металлы ряда – это группа химических элементов, которые растворяются в разбавленной серной кислоте с образованием солей и выделением водорода. Реакция металла с разбавленной серной кислотой основана на способности кислоты отдавать протоны, а металла – принимать их.
К примеру, при взаимодействии разбавленной серной кислоты с металлом цинком, происходит следующая реакция:
Zn + H2SO4 (разб.) → ZnSO4 + H2
В результате реакции образуется сульфат цинка (ZnSO4), который остается растворенным в воде, и выделяется молекула водорода (H2). Таким образом, серная кислота и металл ряда взаимодействуют и образуют новые вещества.
Реакция серной кислоты с металлами ряда является химическим процессом, однако скорость и интенсивность реакции зависят от концентрации серной кислоты, температуры, активности металла и других факторов.
Химические свойства разбавленной серной кислоты
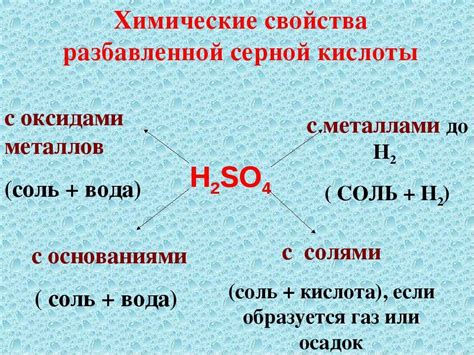
Разбавленная серная кислота (H2SO4) – одна из наиболее распространенных и важных кислот, широко используемая в различных отраслях промышленности и научных исследованиях. У нее множество химических свойств и реакций, которые делают ее незаменимой во многих процессах.
- Окислительные свойства: разбавленная серная кислота обладает сильными окислительными свойствами и способна окислять многие органические и неорганические вещества.
- Реакция с металлами: серная кислота реагирует с металлами ряда, образуя соли и выделяя водород. Эта реакция позволяет использовать серную кислоту в процессах очистки металлов и получения водорода.
- Диссоциация: разбавленная серная кислота диссоциирует на ионы в водном растворе, образуя гидроксидные и сульфатные ионы.
- Реакция с основаниями: серная кислота реагирует с основаниями, образуя соли и воду. Реакция с щелочами проходит с выделением тепла – это эндотермический процесс.
Также разбавленная серная кислота может проводить протолиз и образовывать соединения с различными органическими и неорганическими соединениями. Это делает серную кислоту важным реагентом в химическом синтезе и аналитической химии.
Реакция с металлами ряда

Серная кислота является сильным окислителем и проявляет реактивность при взаимодействии с металлами. Она может образовывать с ними соли серной кислоты, особенно при высоких концентрациях.
Металлы, расположенные выше в ряду активности, такие как натрий, калий и литий, реагируют с серной кислотой достаточно быстро, выбивая водород из раствора. При этом образуется сера и соль с соответствующим металлом.
Например, реакция серной кислоты с натрием (Na) протекает по следующему уравнению:
2H2SO4 + 2Na = 2NaHSO4 + H2O + SO2
В результате реакции образуются сернокислый натрий (NaHSO4), вода (H2O) и диоксид серы (SO2).
Однако, металлы, расположенные ниже в ряду активности, такие как медь, железо и цинк, не реагируют с разбавленной серной кислотой. Это связано с тем, что они не обладают достаточной активностью, чтобы выбивать водород из раствора.
Влияние разбавленной серной кислоты на металлы

Разбавленная серная кислота является одним из наиболее распространенных и активно используемых химических соединений. Ее влияние на металлы может быть различным в зависимости от концентрации кислоты и особенностей каждого металла.
Сильная окислительность серной кислоты может привести к разрушению многих металлов, особенно цветных, таких как медь, свинец, цинк и железа. Взаимодействие металлов с разбавленной серной кислотой может привести к выделению газов, например, водорода.
Металлы, такие как золото и платина, обладают высокой стойкостью к воздействию серной кислоты, поэтому они не подвержены коррозии при взаимодействии с разбавленной серной кислотой.
Однако алюминий при контакте с разбавленной серной кислотой может вызывать реакцию, в результате которой образуется алюминат серебра и выделяется сероводород. Также может произойти выделение гидрогена и образование сульфатов в результате взаимодействия металлов серии щелочных металлов с серной кислотой.
Образование гидроксидов при реакции с металлами

Разбавленная серная кислота обладает высокой реактивностью и способна образовывать соли с различными металлами. При соединении металла с серной кислотой происходит химическая реакция, в результате которой образуется гидроксид металла.
Гидроксиды являются основаниями и характеризуются основными свойствами. При взаимодействии соединения металла с разбавленной серной кислотой, происходит обмен ионами. Металл замещает водород в молекуле кислоты, при этом образуется соответствующий гидроксид металла и выделяется молекула воды.
Образование гидроксидов при реакции с металлами можно представить в виде химических уравнений. Например, при реакции цинка с серной кислотой образуется гидроксид цинка и вода:
Zn + H2SO4 → Zn(OH)2 + H2O
Таким образом, реакция разбавленной серной кислоты с металлами приводит к образованию гидроксидов металлов. Это важный процесс, который находит применение в различных сферах химии и технологии.
Свойства образующихся соляных растворов

1. Кислотные свойства: Соляные растворы, получаемые в результате реакции серной кислоты с металлами ряда, обладают кислотными свойствами. Они способны отдавать протоны в водном растворе, образуя гидроксидные ионы. Это происходит из-за того, что серная кислота сама является кислотой и содержит в своей структуре протонные H+ ионы.
2. Электролитическое поведение: Соляные растворы разбавленной серной кислоты являются электролитами, то есть они проводят электрический ток. Это происходит из-за наличия в растворе ионов металла и гидроксидных ионов.
3. Окислительные и восстановительные свойства: Соляные растворы серной кислоты способны проявлять окислительные или восстановительные свойства в зависимости от металла, с которым они образовались. Некоторые металлы способны окисляться серной кислотой, передавая электроны, в то время как другие металлы могут восстанавливаться благодаря действию серной кислоты.
4. Формирование осадков: Реакция разбавленной серной кислоты с некоторыми металлами может приводить к образованию осадков. Например, реакция с цинком приводит к образованию осадка белого цинка сульфата. Это свойство можно использовать для выделения определенных металлов из растворов.
В целом, соляные растворы, образующиеся при реакции разбавленной серной кислоты с металлами, обладают характеристиками кислот, могут проявлять электролитическое поведение, иметь окислительные или восстановительные свойства, а также формировать осадки в зависимости от металла. Эти свойства определяют их роль в различных химических процессах и применение в различных областях науки и промышленности.
Роль серной кислоты в химических процессах с металлами
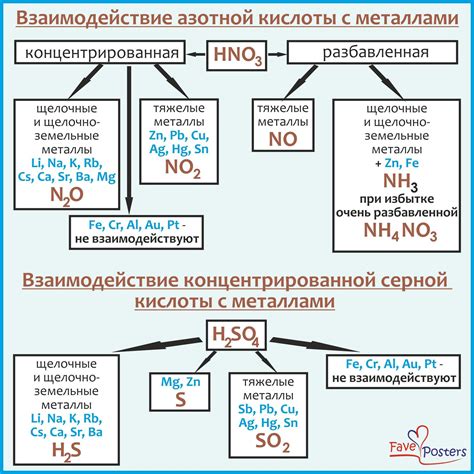
Серная кислота – одно из наиболее распространенных и широко используемых химических веществ. Ее химические свойства позволяют использовать ее для проведения различных реакций с металлами.
Реакция разбавленной серной кислоты со многими металлами приводит к образованию солей серной кислоты. При этом происходит окислительно-восстановительная реакция: металл окисляется, а серная кислота восстанавливается.
Некоторые более реакционные металлы, такие как цинк, железо и алюминий, реагируют с серной кислотой уже при комнатной температуре. В результате образуются соли серной кислоты и выделяется водород. Реакция протекает достаточно интенсивно, с выделением большого количества газа.
Менее реакционные металлы, такие как медь и свинец, реагируют с серной кислотой только при нагревании. При этом происходит образование соответствующих солей серной кислоты и выделение газа. Реакция с медью происходит медленно, а с свинцом – более интенсивно.
Реакция серной кислоты с металлами ряда имеет широкое применение в различных отраслях промышленности. Например, она используется для получения солей серной кислоты, которые применяются в процессе производства удобрений и синтеза органических соединений. Кроме того, серная кислота является важным химическим реагентом при проведении аналитических и лабораторных работ.
Вопрос-ответ

Какие металлы реагируют с разбавленной серной кислотой?
Разбавленная серная кислота реагирует с некоторыми металлами ряда, включая магний (Mg), цинк (Zn), железо (Fe), алюминий (Al) и медь (Cu).
Как происходит реакция металлов ряда с серной кислотой?
Реакция металлов ряда с разбавленной серной кислотой протекает по общей схеме: металл реагирует с кислотой, образуя соль и высвобождая водород. Например, цинк (Zn) и серная кислота (H2SO4) взаимодействуют, образуя цинковый сульфат (ZnSO4) и высвобождая молекулы водорода (H2).
