Перекись водорода (H2O2) является химическим веществом, которое широко используется в медицине, бытовых целях и промышленности. Одним из важных аспектов взаимодействия перекиси водорода с другими веществами является ее реакция с металлами.
Реакция перекиси водорода с металлами зависит от их активности. Некоторые металлы, такие как железо, медь и свинец, не проявляют активности в отношении перекиси водорода и не происходит никакой реакции. Однако, с другими металлами, такими как алюминий, цинк и магний, происходят химические реакции, сопровождающиеся выделением газа.
В результате реакции перекиси водорода с активными металлами образуется газовая среда, состоящая в основном из кислорода и водяного пара. Этот газ может быть очень взрывоопасным, поэтому реакция перекиси водорода с металлами требует осторожности и проведения в специальных условиях.
Одним из примеров реакции перекиси водорода с металлами является реакция с алюминием. При этой реакции образуется водородный газ и гидроксид алюминия. Данная реакция широко используется в ракетных двигателях и прочих приложениях, когда необходимо получить высокие скорости вылета газов. В таких случаях, перекись водорода служит источником кислорода для реакции.
Реакция перекиси водорода с металлами: основные аспекты
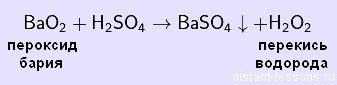
Реакция перекиси водорода с металлами является важным объектом изучения в химии. Она представляет собой химическую реакцию, при которой перекись водорода (Н2O2) взаимодействует с металлами, образуя соответствующие продукты.
В реакции перекиси водорода с металлами главным образом происходит окисление металла. При этом перекись водорода действует как окислитель, передавая свои кислородные атомы металлу. В результате образуются гидроксиды металла и молекулы воды.
Реакция перекиси водорода с металлами может протекать различными способами, в зависимости от химических свойств металла. Некоторые металлы, такие как железо, никель и медь, могут реагировать с перекисью водорода даже при комнатной температуре. Другие металлы, например, алюминий и цинк, требуют нагревания для начала реакции.
Реакция перекиси водорода с металлами может протекать с выделением газов. Например, при взаимодействии перекиси водорода с цинком образуются искры и выделяется водородный газ, что делает реакцию видимой. Кроме того, реакция может сопровождаться нагревом и светоизлучением.
Изучение реакции перекиси водорода с металлами имеет практическое значение. Эта реакция используется, например, в процессе анализа содержания металлов в различных материалах. Кроме того, она может применяться в промышленности для получения гидроксидов металлов.
Химические свойства перекиси водорода при взаимодействии с металлами

Перекись водорода (Н2О2) является неорганическим соединением, обладающим уникальными химическими свойствами. Взаимодействие перекиси водорода с металлами приводит к различным реакциям, обусловленным ее окислительными свойствами и способностью легко распадаться на воду и кислород.
Перекись водорода может реагировать с металлами как в кислотных, так и в щелочных условиях. В кислотной среде перекись водорода окисляет металлы, образуя металлические ионы и воду. В щелочной среде реакция происходит интенсивнее и может сопровождаться выделением водорода.
При взаимодействии перекиси водорода с некоторыми металлами, такими как медь, железо и алюминий, наблюдается растворение металла с образованием соответствующих солей. Эти реакции могут проходить при комнатной температуре, но увеличение температуры ускоряет их протекание.
Взаимодействие перекиси водорода с активными металлами, такими как натрий, калий и магний, сопровождается интенсивным выделением водорода. Данная реакция может протекать поразительно быстро и становится опасной при неправильном обращении с перекисью водорода.
Перекись водорода может также образовывать комплексные соединения с некоторыми металлами, например, с платиной и серебром. Эти соединения обладают уникальными свойствами и широко применяются в химии и медицине.
В целом, взаимодействие перекиси водорода с металлами - сложный и многогранный процесс, который зависит от типа металла, условий реакции и концентрации перекиси. Изучение этих реакций имеет важное значение для разработки новых катализаторов, производства взрывчатых веществ и решения других научно-технических задач.
Вопрос-ответ

Что такое перекись водорода?
Перекись водорода – это химическое соединение, состоящее из молекул, каждая из которых состоит из двух атомов водорода и двух атомов кислорода. Химическая формула перекиси водорода - H2O2. Она обладает мощными окислительными свойствами и может быть использована в различных областях, таких как медицина, химическая промышленность и даже в бытовых целях.
Как перекись водорода реагирует с металлами?
Перекись водорода может реагировать с некоторыми металлами, образуя соединения. Например, сильная окислительная способность перекиси водорода может вызвать реакцию с некоторыми металлами, такими как железо, медь и алюминий. Реакции с металлами могут быть опасными, так как могут приводить к выделению горючих газов или даже вызывать взрывы.
Какие металлы не реагируют с перекисью водорода?
Не все металлы реагируют с перекисью водорода. Некоторые металлы, такие как золото, серебро и платина, не реагируют с перекисью водорода. Это связано с их химической стабильностью и слабыми окислительными свойствами перекиси водорода. Однако, все же не рекомендуется проводить эксперименты с металлами и перекисью водорода без должного знания и опыта, так как такие реакции могут быть опасными.
