Реакция оксидов щелочных металлов с соляной кислотой является одной из фундаментальных химических реакций. Она имеет множество применений в различных областях науки и промышленности. Особый интерес представляет реакция при низкой температуре, так как она обладает рядом особенностей, которые делают ее значимой исследовательской темой.
Одной из ключевых особенностей данной реакции является механизм происхождения ее протекания. При взаимодействии оксидов щелочных металлов с соляной кислотой образуется соответствующая соль и вода. Однако при низкой температуре происходит образование оксихлоридов щелочных металлов, которые обладают уникальными свойствами и находят применение в различных областях науки и промышленности.
Реакция оксидов щелочных металлов с соляной кислотой при низкой температуре имеет широкий спектр применений. Например, оксихлориды щелочных металлов широко используется в производстве огнеупорных материалов, стекла, электродов и катализаторов. Они также находят применение в медицине, а также в процессе получения ряда химических соединений.
Изучение реакции оксидов щелочных металлов с соляной кислотой при низкой температуре позволяет расширить наши знания о физико-химических процессах, происходящих в химических реакциях. Это может привести к разработке новых методов синтеза материалов с уникальными свойствами, а также к улучшению существующих технологий и процессов производства.
Реакция оксидов щелочных металлов с соляной кислотой
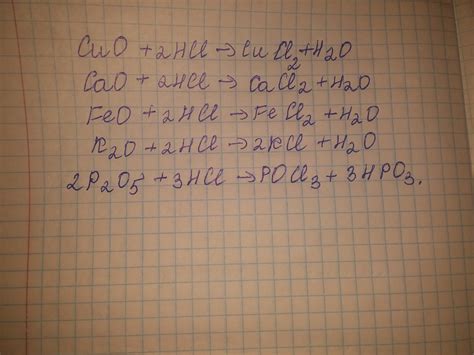
Реакция оксидов щелочных металлов с соляной кислотой представляет собой важный процесс в химии. Оксиды щелочных металлов, таких как натрий (Na2O), калий (K2O) и литий (Li2O), обладают щелочными свойствами и реагируют с соляной кислотой (HCl) при низкой температуре.
В ходе реакции образуется соль и вода. Например, реакция натрия с соляной кислотой протекает следующим образом:
- Na2O + HCl → NaCl + H2O
При этом оксид натрия реагирует с соляной кислотой, образуя соль натрия (хлорид натрия) и воду. Аналогичные реакции происходят и с оксидами других щелочных металлов.
Реакция оксидов щелочных металлов с соляной кислотой является экзотермической, то есть сопровождается выделением тепла. Также при этой реакции могут образовываться газы, например, водород.
Такие реакции широко используются в химической промышленности для получения солей щелочных металлов и других продуктов. Они также применяются в аналитической химии для определения наличия щелочных металлов в образцах. Реакция оксидов щелочных металлов с соляной кислотой относится к основным химическим процессам и знание ее механизма позволяет более глубоко понять химические свойства этих веществ и их взаимодействие с другими соединениями.
Реакция оксида натрия с соляной кислотой при низкой температуре

Реакция оксида натрия с соляной кислотой при низкой температуре является одной из важных реакций, которая может происходить в химической лаборатории. Оксид натрия (Na2O) представляет собой белый кристаллический порошок, который обладает сильными щелочными свойствами. Соляная кислота (HCl) - это бесцветная жидкость с резким запахом, являющаяся одной из самых распространенных кислот.
При смешивании оксида натрия и соляной кислоты при низкой температуре происходит реакция, в результате которой образуется хлорид натрия (NaCl) и вода (H2O). Как правило, реакция сопровождается выделением тепла и созданием шипящего звука.
Реакция оксида натрия с соляной кислотой является экзотермической реакцией, то есть сопровождается выделением тепла. Это объясняет появление тепла и шипящего звука в процессе реакции. Кроме того, при реакции образуются новые вещества - хлорид натрия и вода. Хлорид натрия представляет собой безцветные кристаллы сольного вида, которые хорошо растворяются в воде.
Реакция оксида натрия с соляной кислотой при низкой температуре может использоваться в лабораторных условиях, например, для получения солей или воды. Также эта реакция может быть использована для демонстрации реакции между щелочным оксидом и кислотой в образовании соли и воды.
Взаимодействие оксида калия с соляной кислотой при пониженной температуре

Оксид калия (K2O) является одним из основных оксидов щелочных металлов. Он химически активен и может реагировать с различными соединениями, в том числе с соляной кислотой (HCl).
При взаимодействии оксида калия с соляной кислотой при пониженной температуре происходит образование растворимых солей и воды. В реакцию вступают ионы гидроксида, образующиеся в результате гидратации оксида калия, и ионы водорода из соляной кислоты.
Реакция между оксидом калия и соляной кислотой может быть представлена уравнением:
K2O + 2HCl → 2KCl + H2O
В результате этой реакции образуется хлорид калия и вода. Хлорид калия является растворимым соединением, поэтому он остается в растворе. Вода также остается в реакционной смеси.
Взаимодействие оксида калия с соляной кислотой при пониженной температуре является экзотермической реакцией, то есть сопровождается выделением тепла. Это приводит к увеличению температуры реакционной смеси.
Такое взаимодействие может применяться в различных химических процессах, например, для получения хлорида калия или воды.
Влияние оксида лития на соляную кислоту при низкой температуре
Оксид лития (Li2O) является одним из основных оксидов щелочного металла и активно взаимодействует с соляной кислотой (HCl) даже при низких температурах. Это химическое взаимодействие приводит к образованию реакционной смеси, в которой происходят различные реакции.
Взаимодействие оксида лития с соляной кислотой является экзотермическим процессом, то есть сопровождается выделением тепла. При этом образуются растворимая в воде соль и вода.
Оксид лития обладает мощными щелочными свойствами, поэтому его реакция с соляной кислотой протекает очень активно. Она является одной из наиболее эффективных реакций, чтобы получить соль и воду.
Реакция оксида лития с соляной кислотой может быть представлена схематически следующим образом:
- Li2O + 2HCl → 2LiCl + H2O
Таким образом, взаимодействие оксида лития с соляной кислотой при низкой температуре приводит к образованию хлорида лития и воды. Эта реакция является важным исследовательским объектом в области химии и может применяться для получения воды и солей в промышленности и лабораторных условиях.
Особенности реакции оксида рубидия с соляной кислотой при низкой температуре
1. Формирование раствора соли рубидия и воды.
При взаимодействии оксида рубидия (Rb2O) с соляной кислотой (HCl) происходит образование раствора соли рубидия (RbCl) и воды (H2O). Эта реакция является экзотермической и сопровождается выделением тепла.
2. Образование соляной кислоты и оксида рубидия.
Помимо образования раствора соли рубидия, реакция также приводит к образованию соляной кислоты (HCl) и оксида рубидия (Rb2O). Поскольку оксид рубидия не растворим в воде, он выпадает в виде твердого осадка.
3. Выделение газа.
В результате реакции оксида рубидия с соляной кислотой при низкой температуре выделяется газ – хлорид водорода (HCl). Это можно наблюдать по появлению пузырьков, которые исходят из места взаимодействия реагентов.
4. Увеличение скорости реакции при повышении температуры.
Хотя данная реакция обычно проводится при низких температурах, можно заметить, что при повышении температуры скорость реакции увеличивается. Это объясняется тем, что при повышении температуры частицы реагентов обладают большей кинетической энергией и, следовательно, чаще сталкиваются и взаимодействуют друг с другом.
5. Факторы, влияющие на скорость реакции.
Скорость реакции оксида рубидия с соляной кислотой может зависеть от различных факторов, таких как концентрация реагентов, температура, агрегатное состояние реагентов и наличие катализаторов. Изменение этих факторов может значительно влиять на скорость и характер реакции.
Вопрос-ответ

Какие оксиды щелочных металлов могут реагировать с соляной кислотой при низкой температуре?
Реагировать с соляной кислотой при низкой температуре могут оксиды щелочных металлов, такие как оксид натрия (Na₂O), оксид калия (K₂O), оксид рубидия (Rb₂O) и оксид цезия (Cs₂O).
Почему реакция оксидов щелочных металлов с соляной кислотой происходит при низкой температуре?
Реакция оксидов щелочных металлов с соляной кислотой происходит при низкой температуре, потому что оксиды щелочных металлов являются кислотными оксидами, которые реагируют с кислотой и образуют соль и воду. В данном случае, реакция происходит без нагревания, т.к. образующаяся соль легко растворяется в воде при комнатной температуре.
