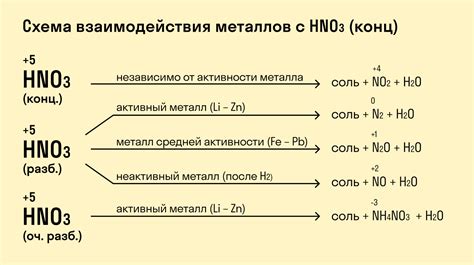
Взаимодействие оксидов металлов с концентрированной серной кислотой является важной темой в химической науке. Серная кислота, также известная как азотная кислота, обладает сильной кислотностью и способна реагировать с различными веществами. Взаимодействие оксидов металлов с серной кислотой может приводить к образованию солей и выделению газов, таких как оксиды азота и диоксид серы.
Оксиды металлов обладают различной активностью и способностью к реакции с серной кислотой. Некоторые оксиды металлов реагируют с серной кислотой медленно и неполно, в то время как другие могут приводить к взрывным реакциям. Активность оксидов металлов в реакции с серной кислотой зависит от их электрохимических свойств, структуры и растворимости в кислотной среде.
При взаимодействии оксидов металлов с концентрированной серной кислотой происходит передача протона от кислоты к металлу, что приводит к образованию солей металлов и воды. Реакция может сопровождаться выделением тепла и газов. Некоторые оксиды металлов, например, оксид железа, обладают амфотерными свойствами и реагируют как с кислотами, так и с щелочами.
Оксиды металлов: характеристика и свойства
Оксиды металлов – это химические соединения, состоящие из атомов металла и кислорода. У каждого металла может быть несколько различных оксидов, образующихся при взаимодействии металла с кислородом.
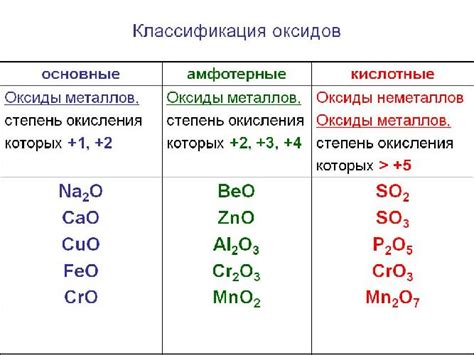
Свойства оксидов металлов зависят от химической природы металла и его окислительной способности. Некоторые оксиды металлов обладают кислотными свойствами, другие - основными, а некоторые оксиды являются амфотерными веществами, т.е. могут реагировать и с кислотами, и с основаниями.
Кислотные оксиды металлов образуются при окислении металла кислородом. Они растворяются в воде, образуя кислотные растворы, например, оксид серы SО2 и оксид азота NО2.
Оксиды металлов с щелочными свойствами образуются при окислении металла кислородом и обладают способностью растворяться в воде с образованием щелочного раствора. Примерами таких оксидов металлов являются гидрооксид натрия NaOH и гидроксид калия КОН.
Амфотерные оксиды металлов могут действовать как кислоты и основания. Они реагируют как с кислотами, так и с основаниями, образуя соли. Примером амфотерных оксидов металлов является оксид алюминия Al2O3.
Изучение взаимодействия оксидов металлов с концентрированной серной кислотой

Взаимодействие оксидов металлов с концентрированной серной кислотой является важной областью исследований в химии. Это процесс, который позволяет понять реакционную способность и свойства оксидов металлов.
Оксиды металлов представляют собой соединения, состоящие из атомов металла и кислорода. Они обладают различными структурами и химическими свойствами. Взаимодействие оксидов металлов с концентрированной серной кислотой может проходить по разным механизмам в зависимости от природы оксида и условий реакции.
В результате взаимодействия оксидов металлов с концентрированной серной кислотой могут образовываться соли и вода. Эти реакции происходят с выделением большого количества тепла и часто сопровождаются различными побочными эффектами, такими как образование сильных дымов или выбросы газов.
Для изучения взаимодействия оксидов металлов с концентрированной серной кислотой применяют различные методы, включающие проведение экспериментальных реакций, анализ полученных продуктов, измерение тепловых эффектов и исследование кинетики реакции.
Изучение взаимодействия оксидов металлов с концентрированной серной кислотой имеет практическое значение для многочисленных отраслей промышленности. Например, данная реакция может использоваться для получения солей металлов или в процессе очистки различных материалов. Кроме того, полученные данные могут быть использованы для оптимизации условий реакции и разработки новых методов синтеза соединений.
Химический состав и структура оксидов металлов

Оксиды металлов представляют собой химические соединения, состоящие из металлического элемента и кислорода. Они обладают различными структурами и свойствами, в зависимости от вида металла и условий образования.
Структура оксидов металлов может быть разнообразной. Некоторые оксиды имеют простую структуру, состоящую из прямых связей между атомами металла и кислорода. Другие оксиды могут образовывать сложные кристаллические структуры, включающие в себя различные типы связей и полимерные цепочки.
Химический состав оксидов металлов также может отличаться. Некоторые оксиды содержат только один атом металла, связанный с одним или несколькими атомами кислорода. Другие оксиды могут содержать два или более атомов металла, образуя так называемые димеры или полимеры.
Структура и химический состав оксидов металлов определяют их свойства и реакционную способность. Некоторые оксиды являются кислотными и реагируют с водой, образуя кислоты. Другие оксиды могут выступать в качестве оснований и реагировать с кислотами. Еще другие оксиды проявляют амфотерные свойства и могут реагировать как с кислотами, так и с основаниями.
Взаимодействие оксидов металлов с концентрированной серной кислотой также определяется их структурой и химическим составом. Оксиды, содержащие реакционно активные металлы, обычно растворяются в серной кислоте с образованием соответствующих солей и выделением кислорода. Однако, не все оксиды металлов способны растворяться в серной кислоте, так как их структура может быть инертной.
Реакции оксидов металлов с концентрированной серной кислотой
Оксиды металлов могут реагировать с концентрированной серной кислотой, образуя соответствующие соли и воду. В реакции между оксидами и серной кислотой происходит обмен ионами, при котором происходит отщепление одного иона и присоединение другого.
Реакция оксида металла с серной кислотой может быть представлена общим уравнением:
МО + H₂SO₄ → MSO₄ + H₂O
где М - металл, О - кислород, H₂SO₄ - серная кислота, MSO₄ - соль металла и H₂O - вода. Примеры взаимодействия оксидов металлов с серной кислотой:
- Оксид кальция (CaO) + H₂SO₄ → CaSO₄ + H₂O;
- Оксид магния (MgO) + H₂SO₄ → MgSO₄ + H₂O;
- Оксид алюминия (Al₂O₃) + H₂SO₄ → Al₂(SO₄)₃ + H₂O;
- Оксид железа (Fe₂O₃) + H₂SO₄ → Fe₂(SO₄)₃ + H₂O.
Многие оксиды металлов растворяются в серной кислоте с образованием солей, которые могут иметь различные степени гидратации. Эти реакции могут происходить с выделением тепла и образованием пены из углекислого газа. При этом важно соблюдать меры безопасности, так как концентрированная серная кислота является агрессивным химическим веществом и требует аккуратного обращения.
Сравнительный анализ реакций с разными типами оксидов металлов
Реакции взаимодействия оксидов металлов с концентрированной серной кислотой могут происходить по разным механизмам и приводить к различным продуктам.
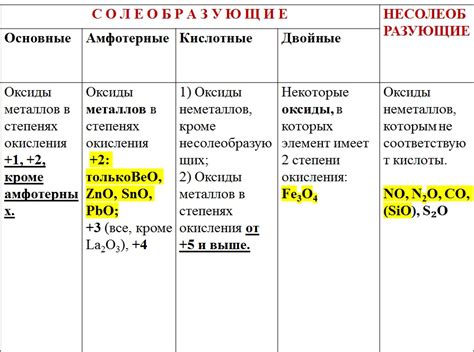
Оксиды неактивных металлов:
Оксиды неактивных металлов, таких как оксид цинка (ZnO) или оксид алюминия (Al2O3), не реагируют с концентрированной серной кислотой при обычных условиях.
В случае оксида цинка, например, не происходит явной реакции с серной кислотой, так как оксид образует защитную пленку, состоящую из нерастворимого сульфата цинка (ZnSO4) и гидроксида цинка (Zn(OH)2), которая предотвращает дальнейшее взаимодействие между оксидом и кислотой.
Оксиды активных металлов:
Оксиды активных металлов, такие как оксид железа(III) (Fe2O3) или оксид натрия (Na2O), реагируют с концентрированной серной кислотой, образуя сульфаты металлов и воду.
Например, оксид железа(III) реагирует с серной кислотой по следующему уравнению: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O. В результате образуется сульфат железа(III) и вода.
Оксиды активных металлов реагируют с серной кислотой, так как активные металлы способны образовывать положительные ионы и взаимодействовать с отрицательными ионами серной кислоты.
Сравнение реакций:
- Оксиды неактивных металлов не реагируют с концентрированной серной кислотой из-за образования защитной пленки.
- Оксиды активных металлов реагируют с серной кислотой, образуя сульфаты металлов и воду.
Сравнивая эти два типа оксидов металлов, можно сделать вывод, что реакция с концентрированной серной кислотой зависит от активности металла. Для неактивных металлов происходит образование защитной пленки, которая предотвращает реакцию, в то время как активные металлы способны взаимодействовать с серной кислотой и образовывать сульфаты металлов.
Изменение свойств оксидов металлов после взаимодействия с серной кислотой

Взаимодействие оксидов металлов с концентрированной серной кислотой приводит к значительным изменениям их свойств. Под воздействием серной кислоты оксиды металлов могут претерпеть изменения как в химическом составе, так и в структуре. В результате такого взаимодействия образуются соединения, которые могут иметь другие физические и химические свойства.
Одним из наиболее заметных изменений, которые происходят с оксидами металлов после взаимодействия с серной кислотой, является изменение цвета. Многие оксиды металлов имеют определенный цвет в своем исходном состоянии, однако после взаимодействия с серной кислотой они могут потерять свой первоначальный цвет или приобрести новый оттенок.
Кроме того, взаимодействие оксидов металлов с серной кислотой может приводить к образованию новых соединений с различными степенями окисления металла. В некоторых случаях могут образовываться соли, содержащие металл в более высокой степени окисления, чем в исходном оксиде.
Также стоит отметить, что взаимодействие оксидов металлов с серной кислотой может сопровождаться выделением газовых продуктов. Например, при взаимодействии оксида железа(III) с серной кислотой образуется газообразный продукт - сернистый газ. Это может быть объяснено разложением серной кислоты с образованием сульфата металла и выделением диоксида серы и воды.
Применение оксидов металлов в промышленности

Оксиды металлов являются важными веществами, широко используемыми в различных отраслях промышленности. Их уникальные свойства делают их необходимыми для выполнения множества производственных процессов.
Одним из наиболее распространенных применений оксидов металлов является использование их в качестве катализаторов. Оксиды металлов, такие как оксид железа, оксид меди или оксид цинка, способны активировать химические реакции и значительно повышать их скорость. Это особенно важно в производстве различных химических соединений и материалов.
Оксиды металлов также широко применяются в электронной промышленности. Они служат основным материалом для создания полупроводниковых устройств, таких как транзисторы и диоды. Оксиды металлов обладают высокой электрической проводимостью и стабильностью в широком диапазоне рабочих температур, что делает их идеальными для использования в электронных приборах.
Другое важное применение оксидов металлов связано с их использованием в качестве красителей и пигментов. Оксиды металлов, такие как оксид железа или оксид титана, придают материалам желаемый цвет и обеспечивают их стойкость к воздействию внешних факторов. Это особенно важно в производстве красок, пластмасс и косметических продуктов.
Некоторые оксиды металлов, такие как оксид алюминия или оксид кремния, используются в производстве керамики и стекла. Они придают материалам прочность, жаростойкость и способность сохранять форму при высоких температурах. Это делает их незаменимыми в создании различных изделий, от посуды и столовых приборов до оконных стекол и приборов лабораторного назначения.
Таким образом, оксиды металлов играют важную роль в промышленности. Они находят применение в различных отраслях, от химической и электронной до косметической и керамической, благодаря своим уникальным свойствам и возможностям. Без оксидов металлов многие процессы промышленного производства были бы невозможными или крайне затруднительными.
Вопрос-ответ

Какие оксиды металлов взаимодействуют с концентрированной серной кислотой?
С концентрированной серной кислотой взаимодействуют оксиды металлов, которые обладают высокой активностью. В частности, это оксиды щелочных и щёлочноземельных металлов, такие как оксид натрия (Na2O), оксид калия (K2O), оксид кальция (CaO) и др.
Чем обусловлено взаимодействие оксидов металлов с концентрированной серной кислотой?
Взаимодействие оксидов металлов с концентрированной серной кислотой обусловлено ионно-молекулярными реакциями. При контакте с серной кислотой оксиды металлов растворяются, образуя соответствующие соли и воду. Процесс сопровождается выделением тепла и образованием сероводорода.
