Оксиды металлов, в зависимости от своих химических свойств, могут проявлять различную реакцию при контакте с водой. Вода является одним из основных реагентов, с которыми взаимодействуют оксиды металлов. Этот процесс считается одним из важных с точки зрения химии и различных промышленных процессов.
Вода обладает уникальными свойствами, которые позволяют ей взаимодействовать с различными веществами. Когда оксид металла попадает в воду, он может растворяться, образуя солюбильные ионные соединения. Также возможно образование кислот, оснований или солей.
Примером взаимодействия оксида металла с водой является реакция оксида натрия. Этот оксид образует щелочное гидроксидное соединение - гидроксид натрия (NaOH), которое известно под названием пищевая сода или каустическая сода. Гидроксид натрия широко используется в различных отраслях, включая промышленность, медицину и пищевую промышленность.
Взаимодействие оксида металла с водой представляет большой интерес для исследователей и промышленников. Изучение этого процесса позволяет более глубоко понять химические свойства оксидов металлов и использовать их в различных технологических процессах. Кроме того, разработка эффективных способов взаимодействия оксидов металлов с водой может значительно повысить эффективность различных производств и улучшить качество получаемой продукции.
Химические реакции оксида металла с водой

Взаимодействие оксида металла с водой - это химическая реакция, при которой оксид металла реагирует с молекулами воды, образуя новые вещества и проявляя различные свойства. Такие реакции могут иметь как экзотермический, так и эндотермический характер.
Реакция оксида металла с водой может приводить к образованию гидроксида металла и выделению водорода в виде газа. В таком случае, в результате реакции образуется растворимая соль, которая может быть в виде осадка или оставаться в растворе.
Например, оксид железа (II) FeO при взаимодействии с водой образует гидроксид железа (II) Fe(OH)2 и выделяет водородный газ:
FeO + H2O → Fe(OH)2 + H2↑
Взаимодействие оксида металла с водой может происходить даже взрывоопасным образом. Некоторые металлические оксиды, например, нитрид натрия Na3N, образуют при реакции со водой аммиак NH3 и гидроксид натрия NaOH, в сопровождении интенсивного выделения газа:
Na3N + 3H2O → 3NaOH + NH3↑
Такие реакции имеют важное практическое применение, например, в процессе получения водорода, где оксиды металла служат реагентами для образования этого газа.
Часто такие реакции сопровождаются теплообразованием, так как они протекают с выделением или поглощением энергии. Реакции оксидов металлов с водой могут быть как спонтанными, так и требующими катализаторов или изменения условий реакции для инициирования.
Таким образом, взаимодействие оксида металла с водой является важным и интересным явлением в химии, которое находит применение в различных процессах и имеет большое значение для понимания реакций веществ.
Гидролиз оксида металла в присутствии воды

Гидролиз оксида металла в присутствии воды представляет собой процесс разложения оксидов металлов под воздействием воды на ионные формы или гидроксиды металлов. Чаще всего гидролиз оксида металла протекает с образованием гидроксида металла.
В зависимости от свойств и химической активности металла, гидролиз может протекать с различной силой и образовывать разные гидроксиды. Например, оксид натрия (Na2O) гидролизуется с образованием гидроксида натрия (NaOH), который является сильным щелочным раствором.
В некоторых случаях, гидролиз оксида металла может протекать с образованием не только гидроксидов, но и других веществ. Например, оксид алюминия (Al2O3) гидролизуется с образованием гидроксида алюминия (Al(OH)3) и кислорода. Гидроксид алюминия образует сложные соли с кислотами или щелочами, такие как алюминий сульфат (Al2(SO4)3) или алюминий натрия сульфат (NaAlSO4).
Образование гидроксида металла и выделение водорода

Гидроксид металла образуется при взаимодействии оксида металла с водой. Этот процесс является реакцией окисления водорода водой. При этом, оксид металла диссоциирует в воде, образуя ионы металла и ионы гидроксида.
Например, оксид железа (III), Fe2O3, взаимодействует с водой по следующему уравнению:
- Fe2O3 + H2O → 2FeOOH
Полученный гидроксид металла – гидроксид железа (III). При этой реакции выделяется водород.
Возможна также реакция образования гидроксида металла через взаимодействие непосредственно металла с водой. Например, натрий (Na) взаимодействуя с водой, образует гидроксид натрия и выделяет молекулы водорода:
- 2Na + 2H2O → 2NaOH + H2
Образование гидроксида металла и выделение водорода является одной из важнейших реакций в химической промышленности. Гидроксиды металлов широко используются в производстве различных веществ и материалов. Водород, выделяющийся при этой реакции, применяется в качестве сырья для производства аммиака, удобрений, пластмасс и других продуктов.
Физические свойства оксида металла

Оксид металла - вещество, состоящее из атомов металла и кислорода. У оксидов металлов есть ряд характерных физических свойств, которые определяют их поведение во взаимодействии с водой и другими веществами.
Точка плавления и кипения: Каждый оксид металла имеет свою собственную температуру плавления и кипения, которая зависит от химической природы металла. Например, оксид железа имеет температуру плавления около 1 538 °C, а оксид алюминия - около 2 000 °C.
Плотность: Оксиды металлов обычно обладают высокой плотностью из-за своего металлического компонента. Например, оксид меди имеет плотность около 6 г/см³, в то время как оксид свинца - около 7,2 г/см³.
Цвет: Оксиды металлов могут иметь разные цвета в зависимости от своей химической структуры. Некоторые оксиды, такие как оксид железа, могут быть красными, желтыми или коричневыми, в то время как другие могут быть чёрными или белыми.
Растворимость: Некоторые оксиды металлов растворяются в воде, образуя основания или кислоты. Например, оксид кальция растворяется в воде, образуя щёлочную среду, а оксид алюминия растворяется в щелочи, образуя кислые растворы.
Твердость: Оксиды металлов обычно являются твёрдыми веществами. Некоторые оксиды, такие как оксид алюминия, обладают высокой твердостью и используются в производстве абразивных материалов.
Температура плавления и кипения
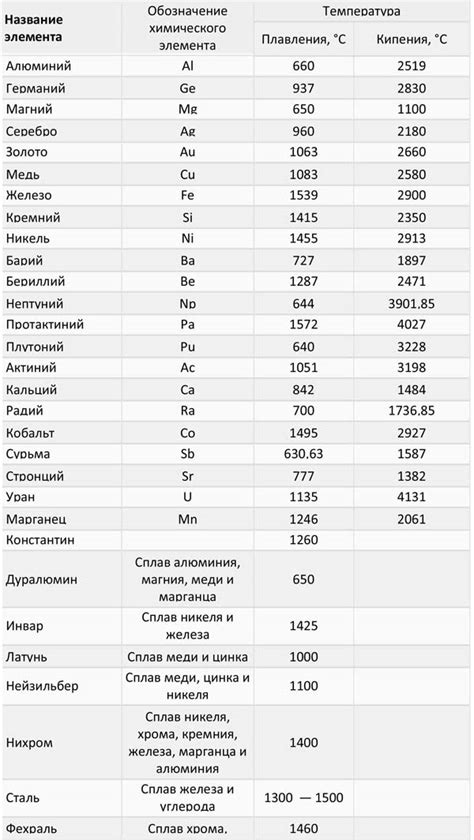
Оксиды металлов обладают различной температурой плавления и кипения в зависимости от их химической структуры и свойств. В большинстве случаев, оксиды металлов являются соединениями, которые обладают высокой термической стабильностью и высокими температурами плавления и кипения. Это связано с тем, что связи между атомами в оксидном кристаллической решетке являются очень прочными и требуют больших энергетических затрат для их нарушения.
Например, оксиды металлов таких элементов, как магний (MgO), алюминий (Al2O3) и кремний (SiO2), обладают очень высокими температурами плавления и кипения. Температура плавления магния оксида составляет около 2800 °C, а температура его кипения превышает 3800 °C. Алюминиевый оксид имеет температуру плавления около 2050 °C и кипения около 3000 °C. Кремниевый оксид, который является основным компонентом песчаника, имеет температуру плавления около 1710 °C и кипения около 2230 °C.
Температура плавления и кипения оксидов металлов может быть изменена путем добавления примесей или аморфизации структуры. Например, добавление примесей к оксидам металлов может снизить их температуры плавления и кипения. Аморфные оксиды металлов, такие как аморфный кремний (a-SiO2), могут иметь более низкую температуру плавления и кипения по сравнению с их кристаллическими формами.
Форма и цвет оксида металла

Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Форму и цвет оксида металла определяют его свойства и структуру. В зависимости от металла и его окислительного состояния, оксиды могут иметь различные формы и цвета.
Форма оксида металла может быть разнообразной. Некоторые оксиды имеют кристаллическую структуру, например, оксид цинка образует цинковитые кристаллы, а оксид алюминия - гематитные кристаллы. Другие оксиды металлов могут иметь аморфную структуру, они не образуют регулярные кристаллические решетки и имеют более хаотичное строение.
Цвет оксидов металлов может варьировать от белого до черного и от красного до желтого. Например, оксид железа(III) имеет красно-коричневый цвет и называется красным железным оксидом или ржавчиной. Оксид алюминия обычно имеет белый цвет, но может быть окрашен в различные оттенки, включая коричневый, синий или зеленый. Некоторые оксиды металлов, такие как оксид кобальта(II) или оксид меди(II), имеют характерный синий или зеленый цвет. Однако, оксиды металлов могут быть и черные, например, оксид свинца(II) или оксид марганца(IV).
Цвет оксида металла зависит от его электронной структуры и вариабельности окислительного состояния металла. Иногда на цвет оксида металла может влиять его наноструктура или примеси других элементов. Например, оксиды металлов, в которых металл находится в высоком окислительном состоянии, обычно имеют яркие цвета, так как в них есть разнообразные загрязнения или примеси атомов других элементов.
Примеры взаимодействия оксида металла с водой

Взаимодействие оксида металла с водой может происходить по разным сценариям и иметь различные результаты. Рассмотрим несколько примеров.
Примером взаимодействия оксида металла с водой может служить реакция алюминия с водой. При контакте алюминия с водой образуется оксид алюминия (Al2O3) и выделяется водородный газ.
Еще одним примером является реакция железного оксида (Fe2O3) с водой. При взаимодействии этих веществ образуется гидроксид железа (Fe(OH)3) и выделяется водород.
Если рассмотреть оксид кальция (CaO), то при его контакте с водой образуется гидроксид кальция (Ca(OH)2), который широко используется в строительстве и других отраслях.
Еще одним интересным примером является взаимодействие оксида цинка (ZnO) с водой. При этой реакции образуется гидроксид цинка (Zn(OH)2), который обладает антибактериальными свойствами и используется в медицине.
Таким образом, взаимодействие оксида металла с водой может приводить к образованию новых веществ и иметь различные практические применения.
Реакция оксида железа(III) с водой

Оксид железа(III), также известный как гематит, является химическим соединением, обладающим формулой Fe2O3. При контакте с водой происходит реакция оксида железа(III) с образованием гидроксида железа(III) Fe(OH)3 и выделением энергии.
Реакция оксида железа(III) с водой является экзотермической, то есть сопровождается выделением тепла. В результате этой реакции образуется темно-коричневая муть и обильное выделение газа. Гидроксид железа(III) плохо растворим в воде и образует нерастворимые осадки.
Реакция оксида железа(III) с водой играет важную роль в природных и технологических процессах. Например, этот процесс является одним из механизмов происхождения ржавчины на металлических поверхностях с содержанием железа. Также реакция оксида железа(III) с водой используется в производстве катализаторов и других химических веществ.
В целом, реакция оксида железа(III) с водой является важным процессом, который происходит в нашей окружающей среде и имеет различные приложения в промышленности.
Вопрос-ответ

Каким образом происходит взаимодействие оксида металла с водой?
Взаимодействие оксида металла с водой происходит посредством химической реакции, в результате которой образуется соответствующий гидроксид металла и высвобождается молекулярный водород.
Какие металлы образуют гидроксиды при взаимодействии с водой?
Ряд металлов образует гидроксиды при взаимодействии с водой. К ним относятся щелочные металлы (натрий, калий, литий), щелочноземельные металлы (магний, кальций), а также некоторые другие металлы, такие как алюминий.
Можно ли наблюдать взаимодействие оксида алюминия с водой?
Оксид алюминия взаимодействует с водой только при нагревании до высоких температур. В результате взаимодействия образуется гидроксид алюминия, который также растворим в воде. Реакция записывается следующим образом: Al2O3 + 3H2O → 2Al(OH)3.
