Взаимодействие оксида алюминия (Al2O3) с оксидами металлов - это процесс, который имеет свои особенности и может протекать по разным механизмам в зависимости от условий и химических свойств оксидных соединений.
Первоначально следует отметить, что оксид алюминия - это не только часто встречающийся природный минерал, но и важное промышленное вещество. Он обладает высокой степенью стабильности и химической инертности, что связано с наличием плотно упакованной структуры и сильными ионными связями в кристаллической решетке.
Взаимодействие оксида алюминия с оксидами металлов может приводить к образованию различных соединений, в том числе двойных оксидов. Эти соединения обычно обладают уникальными свойствами и могут найти применение в различных областях науки и техники. Особенностью реакции является образование стабильных соединений с высокой температурой плавления и теплопроводности.
Кроме того, взаимодействие оксида алюминия с оксидами металлов может протекать с образованием различных структурных фаз. Например, в реакции с оксидом железа (Fe2O3) возможно образование спинелевых структур, которые обладают высокой механической прочностью и электрической проводимостью.
Реакция оксида алюминия с оксидами металлов
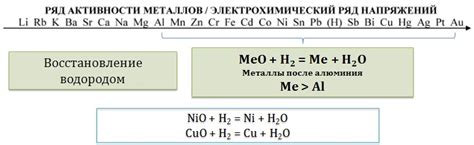
Оксид алюминия, также известный как глинозем, обладает прочными связями и высокой температурной стойкостью. Поэтому он широко применяется в различных отраслях промышленности. При взаимодействии с оксидами металлов, оксид алюминия демонстрирует ряд интересных особенностей реакции.
Прежде всего, следует отметить, что в обычных условиях оксид алюминия не реагирует с большинством оксидов металлов:
- Оксид железа (Fe2O3) не реагирует с оксидом алюминия.
- Оксид меди (CuO) не реагирует с оксидом алюминия.
- Оксид цинка (ZnO) не реагирует с оксидом алюминия.
Однако некоторые оксиды металлов могут проявлять активность в реакции с оксидом алюминия. Например:
- Оксид натрия (Na2O) реагирует с оксидом алюминия при нагревании, образуя соль – алюминат натрия:
| 2 Na2O | + | Al2O3 | → | 2 NaAlO2 |
|---|
- Оксид калия (K2O) также реагирует с оксидом алюминия при нагревании, образуя алюминат калия:
| 2 K2O | + | Al2O3 | → | 2 KAlO2 |
|---|
Таким образом, можно сделать вывод, что взаимодействие оксида алюминия с оксидами металлов зависит от конкретной пары веществ и требует определенных условий для реакции.
Особенности взаимодействия

Взаимодействие оксида алюминия с оксидами металлов имеет свои особенности, которые необходимо учитывать при исследовании и применении этих соединений.
1. Формирование сплавов
При контакте оксида алюминия с определенными оксидами металлов может происходить образование сплавов. Это связано с возможностью рассматривать оксиды металлов как оксианионы, которые могут взаимодействовать с катионами алюминия. Такое взаимодействие может приводить к образованию новых соединений с измененными физическими и химическими свойствами.
2. Влияние структуры
Структура оксида алюминия и оксидов металлов играет важную роль в процессе взаимодействия. Например, для получения сплавов металлов с оксидом алюминия может быть решающим фактором не только соотношение атомов, но и тип кристаллической решетки. Это объясняется тем, что взаимодействие может происходить на поверхности или внутри кристаллической структуры.
3. Термодинамические условия
Особенности взаимодействия оксида алюминия с оксидами металлов также связаны с термодинамическими условиями. Температура, давление и концентрация веществ могут влиять на ход реакции и продукты ее процесса. Изменение термодинамических условий может приводить к изменению характера взаимодействия.
В целом, взаимодействие оксида алюминия с оксидами металлов является сложным процессом, требующим учета различных факторов. Изучение особенностей этого взаимодействия позволяет получить новые материалы с улучшенными свойствами и применить их в различных отраслях промышленности и науки.
Факторы, влияющие на реакцию

Реакция между оксидом алюминия и оксидами металлов может быть подвержена влиянию различных факторов, которые могут существенно изменить ее характер и скорость.
Химическая природа металла: Одним из наиболее значимых факторов является химическая природа использованных оксидов металлов. Реактивность оксидов может варьироваться в зависимости от их электрохимических свойств. Например, оксиды металлов с более высокими значениями окислительной способности могут взаимодействовать с оксидом алюминия более интенсивно.
Размеры частиц: Размеры частиц оксидов металлов и оксида алюминия также могут оказывать влияние на реакцию. Частицы меньшего размера имеют большую поверхность, что способствует более интенсивному контакту между реагентами и увеличивает скорость реакции.
Температура: Температура является одним из наиболее важных факторов, влияющих на ход реакции. Повышение температуры может активировать реакцию и увеличить скорость образования продуктов. Также высокая температура может способствовать фазовому переходу и изменить структуру полученных соединений.
Содержание примесей: Присутствие примесей в оксидах металлов и оксиде алюминия может значительно влиять на реакцию. Некоторые примеси могут выступать в качестве катализаторов и ускорять процесс взаимодействия, в то время как другие могут замедлять или снижать эффективность реакции.
Реакционная среда: Химическая природа реакционной среды также может оказывать существенное влияние на реакцию. Реакции могут протекать по-разному в щелочной, кислотной или нейтральной среде. Например, щелочные среды могут способствовать образованию солей в результате реакции оксида алюминия с оксидами металлов.
Все эти факторы взаимодействуют друг с другом и могут оказывать комплексное влияние на реакцию между оксидом алюминия и оксидами металлов. Понимание этих факторов помогает лучше понять и контролировать данную химическую реакцию.
Вопрос-ответ

Какие оксиды металлов могут взаимодействовать с оксидом алюминия?
Оксид алюминия может взаимодействовать с различными оксидами металлов, такими как оксид железа (Fe2O3), оксид титана (TiO2), оксид меди (CuO) и т.д.
Какие реакции происходят при взаимодействии оксида алюминия с оксидом железа?
При взаимодействии оксида алюминия с оксидом железа происходит реакция, в результате которой образуется смесь Fe3O4 и Al2O3.
