Реакция обмена – это один из основных видов химических реакций, которые происходят между различными химическими веществами. В этой статье мы рассмотрим реакцию обмена, которая происходит между щелочью, оксидом металла, солью и водой.
Щелочь является основой, которая обладает высоким рН и образуется при сочетании щелочного оксида с водой. В результате реакции обмена щелочь выделяется из соли, которая вступает в реакцию с оксидом металла. Оксид металла, seinerseits, также известный как основа или соль, образуется в результате сочетания металла с кислородом.
Реакция обмена между щелочью, оксидом металла, солью и водой является необратимой, то есть происходит с образованием новых веществ. В результате реакции обмена могут образовываться различные соединения в зависимости от начальных веществ. Например, реакция обмена между щелочью, оксидом металла и солью может привести к образованию новой соли и воды.
Щелочь: как она взаимодействует с оксидом металла?
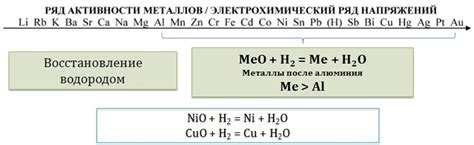
Щелочь - это химическое вещество, которое имеет щелочную среду. Когда щелочь взаимодействует с оксидом металла, происходит реакция обмена. В результате этой реакции образуется соль и вода.
В ходе взаимодействия щелочи с оксидом металла происходит гидролиз оксидной связи. Щелочь выступает в роли основания, а оксид металла - в роли кислоты. При этом происходит протекание протолитической реакции, в результате которой оксидно-металлическая связь расщепляется на кислород и металл, а щелочь дает свободную щелочную группу.
Часто взаимодействие щелочи с оксидом металла сопровождается образованием основных солей. Основные соли - это соли, в состав которых входит щелочная группа, атомы металла и отрицательные радикалы. Образующаяся соль выделяется в виде осадка, и образуется вода.
В целом, взаимодействие щелочи с оксидом металла является одной из типичных реакций обмена. Эта реакция происходит при наличии соответствующих условий и способствует образованию основных солей и воды.
Оксид металла: его свойства и химический состав
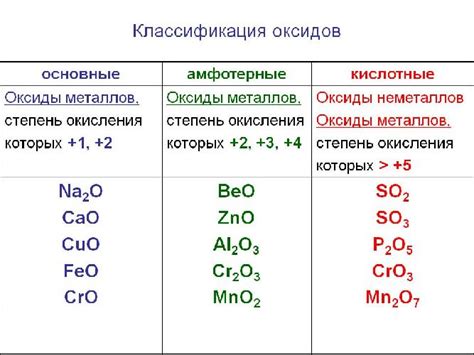
Оксид металла представляет собой химическое соединение, состоящее из атомов металла и кислорода. Химическая формула оксида металла обычно записывается в виде МхОу, где М обозначает металл, а х и у — числа, указывающие на количество атомов металла и кислорода соответственно.
Свойства оксидов металлов могут быть различными в зависимости от конкретного металла и его валентности. В общем случае оксиды металлов являются твёрдыми веществами с высокой температурой плавления и кипения. Они обладают химической активностью и могут быть взаимодействовать с различными веществами.
Оксиды металлов имеют разнообразные применения. Некоторые из них используются в качестве катализаторов, а другие — в производстве стекла, керамики и электронных компонентов. Они также могут быть использованы для получения металлов из их руды, а также в производстве красок, лаков и пигментов.
Щелочь: характеристики и основные свойства

Щелочь - это класс химических веществ, который обладает особыми свойствами и используется во многих сферах нашей жизни. Щелочные вещества губительно действуют на живые организмы и могут вызывать ожоги, поэтому требуют быть использованы с осторожностью.
Основные свойства щелочи:
- Щелочные растворы обладают щелочным вкусом и горьким запахом.
- Щелочи обладают высокой щелочностью и способны растворять многие материалы, в том числе жиры и масла.
- Щелочи хорошо растворяются в воде, образуя гидроксиды щелочных металлов.
- Взаимодействие щелочей с кислотами приводит к образованию солей и воды.
- Щелочные растворы могут вызывать раздражение и ожоги на коже и слизистых оболочках человека.
Одним из наиболее распространенных представителей щелочей является гидроксид натрия, или каустическая сода. Ее используют в различных отраслях промышленности, в бытовых условиях и в медицинских целях. Гидроксид калия, или пищевая щелочь, используется в пищевой промышленности для регулирования pH и как ингредиент в реагентах и препаратах.
Важно помнить, что использование щелочных веществ требует соблюдения мер безопасности. При работе с щелочами необходимо использовать защитные средства, такие как резиновые перчатки, предохранительные очки и защитную одежду.
Химическая реакция: образование соли и воды

Химическая реакция образования соли и воды является одной из основных реакций обмена, также известных как нейтрализационные реакции. В ходе этой реакции происходит образование именно этих двух веществ - соли и воды.
Нейтрализационные реакции возникают при взаимодействии кислоты и щелочи. Когда кислота встречается с щелочью, происходит образование соли и воды. Вода образуется в результате сложного процесса, при котором происходит растворение ионов гидроксида отщелачивающего вещества в ионах водорода кислотного вещества.
Такая реакция является эндотермической, то есть сопровождается поглощением энергии. Она происходит при большом количестве химических процессов, например, при нейтрализации серной кислоты раствором гидроксида натрия. В результате этой реакции образуется натриевая соль и вода.
Важно отметить, что вещества, участвующие в этой реакции, могут быть как твёрдыми, так и жидкими. Нейтрализационные реакции широко применяются в различных отраслях, в том числе в производстве медикаментов и удобрений. Учет реакции образования соли и воды позволяет контролировать процесс и получить требуемые продукты.
Вопрос-ответ

Что такое реакция обмена?
Реакция обмена, также известная как двойная замена, - это тип химической реакции, в которой ионы двух реагентов обмениваются местами, образуя два новых соединения.
Какие вещества участвуют в реакции обмена?
В реакции обмена обычно участвуют два реагента. Часто это может быть соединение, содержащее щелочь (например, гидроксид натрия), и соединение, содержащее кислоту (например, соляная кислота). Результатом реакции будет образование соли и воды.
Как происходит реакция обмена?
В реакции обмена ионы одного реагента обмениваются местами с ионами другого реагента. Например, если в реакции участвует гидроксид натрия (NaOH) и соляная кислота (HCl), ионы гидроксида натрия (OH-) обмениваются местами с ионами водорода (H+) в соляной кислоте. Результатом реакции будет образование соли (натрия и хлора) и воды.
