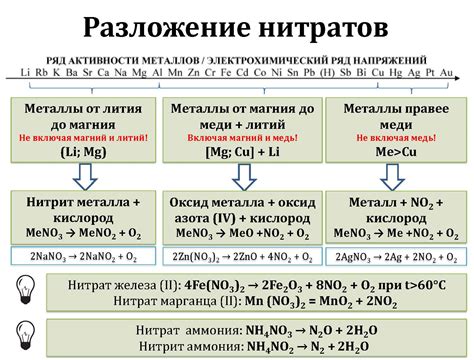
Нитраты представляют собой соли и эстеры азотной кислоты, которые широко используются в различных отраслях промышленности и сельского хозяйства. Их важное свойство заключается в способности взаимодействовать с металлами, что приводит к образованию соответствующих нитратных соединений.
Одной из особенностей взаимодействия нитратов с металлами является их высокая реакционность. Нитраты могут быстро и легко окисляться при действии металлов, что приводит к образованию оксидов металлов и воды. Такое взаимодействие особенно интенсивно происходит с металлами, обладающими высокими степенями окисления, например, с медью, железом, свинцом и другими.
Взаимодействие нитратов с металлами может привести к процессу растворения металла. При этом происходит образование нитратных соединений, а также выделение оксидов металлов. Например, реакция нитрата меди с железом приводит к образованию нитрата железа и осаждению оксида меди. Такая реакция имеет практическое применение в металлургии и химической промышленности.
Роль нитратов в химических реакциях металлов
Нитраты - это соли азотной кислоты, которые активно взаимодействуют с металлами. Их роль в химических реакциях металлов заключается в том, что они могут служить в качестве окислителей или восстановителей.
Окисление металлов нитратами является одной из основных реакций, происходящих при взаимодействии этих веществ. В результате окисления металлов происходит образование соответствующего нитратного иона и протекает ряд химических изменений.
Нитратные ионы могут проявлять свои окислительные свойства, способствуя окислению других веществ. Они могут взаимодействовать с металлами и приводить к образованию соответствующих нитритных соединений.
Восстановление нитратов металлами также является химической реакцией, в которой металл действует в качестве восстановителя. При этом нитратный ион превращается в аммиачный ион, окислительные свойства которого намного меньше, чем у нитратного иона.
Более того, некоторые металлы способны к катодному восстановлению, то есть к восстановлению нитратного иона с образованием соответствующего металла или металлического отложения.
Таким образом, нитраты играют важную роль в химических реакциях с металлами, способствуя их окислению или восстановлению и приводя к образованию новых химических соединений.
Взаимодействие нитратов с металлами: обзор

Нитраты, являясь солями азотистой кислоты, обладают значительной реакционной активностью и способностью взаимодействовать с различными металлами. Эти реакции часто сопровождаются образованием осадков, изменением окраски раствора и проявлением сильных окислительных свойств. Взаимодействие нитратов с металлами находит применение в различных областях, включая химическую промышленность, медицину и научные исследования.
За счет своей структуры, нитраты образуют с металлами комплексные соединения. Часто взаимодействие происходит с образованием осадков, которые могут иметь различные цвета и физические свойства. Например, взаимодействие нитрата серебра AgNO3 с хлоридами различных металлов приводит к образованию хлоридов металлов и осадка серебра, который имеет ярко-желтый цвет. Это свойство используется для анализа наличия хлорида в образцах и исследования его концентрации.
Взаимодействие нитратов с металлами часто сопровождается проявлением их окислительных свойств. Например, реакция нитрата меди Cu(NO3)2 с железом Fe приводит к окислению железа до Fe2O3 и образованию нитрата меди Cu(NO3)2. Такие реакции широко используются в качестве окислительных реагентов и в процессах получения различных продуктов.
Таким образом, взаимодействие нитратов с металлами представляет интересную область исследований и имеет практическое значение в химической промышленности и научных исследованиях. Эти реакции часто сопровождаются образованием осадков и проявлением окислительных свойств, что делает их важными для различных областей применения.
Особенности реакции нитратов с металлами: физические аспекты

Реакция нитратов с металлами является одним из важных физических аспектов химических процессов. Нитраты, как и многие другие соли, обладают высокой степенью растворимости в воде, поэтому их легко можно диссоциировать и образовать ионы нитратов. Это позволяет проводить реакции с металлами в водных растворах, что облегчает исследование их физических свойств и взаимодействий.
Реакции нитратов с металлами также характеризуются возможностью образования комплексных соединений. Например, медь может образовать комплексные ионы с нитратами, что придает им особые физические свойства. Кроме того, реакции таких соединений с металлами могут приводить к образованию стабильных оксидов металлов, что делает их полезными в различных технологических процессах и промышленности.
Взаимодействие нитратов с металлами также зависит от их электрохимических свойств. Нитраты, как правило, обладают окислительной активностью, способствуя окислению металлических ионов и образованию их ионов более высокой валентности. Это позволяет использовать некоторые нитратные соединения в качестве катализаторов в различных процессах, включая синтез химических соединений и промышленное производство.
Таким образом, реакции нитратов с металлами представляют собой комплексные физические процессы, включающие диссоциацию солей, образование комплексных соединений и окислительно-восстановительные реакции. Изучение этих аспектов позволяет более глубоко понять интеракции между нитратами и металлами и применить их в различных областях науки и технологии.
Механизмы образования нитратных соединений с металлами

Образование нитратных соединений с металлами происходит в результате реакции металла с нитратным ионом. В зависимости от особенностей металла и условий реакции, механизм образования нитратных соединений может различаться.
Для некоторых металлов, таких как литий, натрий или калий, вступление в реакцию с нитратным ионом происходит с образованием нитратных соединений прямо в водном растворе. В этом случае металл полностью диссоциирует, а нитратный ион становится полностью анионом.
Другие металлы, такие как железо или медь, могут образовывать нитратные соединения в результате окислительно-восстановительной реакции. В этом случае металл подвергается окислению, а нитратный ион выступает в роли окислителя.
Еще одним механизмом образования нитратных соединений с металлами может быть образование комплексных соединений. Нитратный ион может осуществлять координационную связь с металлом, образуя комплекс, в котором нитратный ион является лигандом для металлического иона.
Важно отметить, что механизм образования нитратных соединений с металлами также зависит от реакционной среды и условий проведения реакции. Например, в присутствии кислорода металл может образовать окисленные нитратные соединения, а в кислой среде может происходить образование кислых нитратов.
Важность нитратных соединений в различных сферах
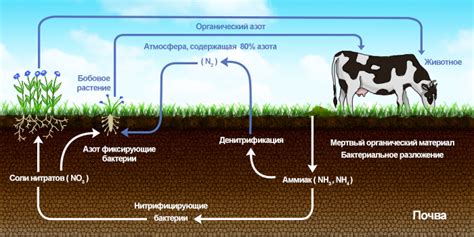
Нитратные соединения являются важными веществами, которые находят применение в различных сферах человеческой деятельности. Они используются в пищевой промышленности, медицине, сельском хозяйстве и других областях.
В пищевой промышленности нитратные соединения широко применяются как консерванты и антиоксиданты. Они помогают сохранить свежесть и качество пищевых продуктов, предотвращая развитие бактерий и гниение. Нитраты используются в производстве мясных изделий, рыбных консервов, сыров и других продуктов.
В медицине нитраты используются в качестве лекарственных препаратов для лечения и профилактики сердечно-сосудистых заболеваний. Они расширяют сосуды и улучшают кровообращение, что помогает снизить давление и улучшить состояние пациентов.
В сельском хозяйстве нитраты используются как удобрения для повышения плодородия почвы и увеличения урожайности. Они содержат азот, который является одним из основных питательных веществ для растений. Нитратные удобрения помогают растениям расти быстрее и образовывать больше плодов.
Кроме того, нитратные соединения находят применение в производстве взрывчатых веществ, косметике, фотографии и других отраслях промышленности. Их свойства, такие как стабильность и возможность образования реактивных соединений, позволяют использовать их в широком спектре процессов и продуктов.
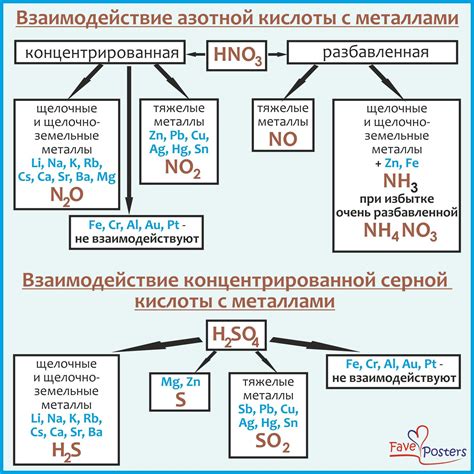
Химические свойства нитратов и их взаимодействие с металлами
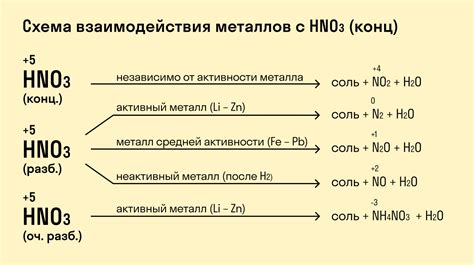
Нитраты - это соединения, состоящие из ионов нитратного радикала (NO3-) и ионов металла. Эти соединения обладают рядом химических свойств, которые влияют на их взаимодействие с металлами.
Одним из важных свойств нитратов является их растворимость в воде. Большинство нитратов хорошо растворимы в воде, образуя прозрачные растворы. Это обуславливает их широкое распространение и использование в различных отраслях промышленности и научных исследованиях.
Нитраты могут взаимодействовать с металлами разными способами. В некоторых случаях нитраты могут выступать в роли окислителя и окислять металлические ионы до более высокой степени окисления. Например, нитрат меди (II) (Cu(NO3)2) при нагревании окисляет ион меди (Cu2+) до иона меди (II, III) (Cu3+).
Нитраты также могут взаимодействовать с металлами, образуя осадки или комплексные соединения. Например, нитрат цинка (Zn(NO3)2) при взаимодействии с гидроксидом натрия (NaOH) образует осадок гидроксида цинка. Этот процесс обусловлен образованием слаборастворимого соединения цинка (Zn(OH)2).
Нитраты также могут образовывать комплексные соединения с металлами, которые обладают различными свойствами и могут использоваться в качестве катализаторов или красителей. Например, нитрат железа (III) (Fe(NO3)3) может образовывать комплексные соединения с аммиаком, образуя красное соединение октаэтриацианоферриит железа (III).
Применение нитратов в производстве и промышленности

Нитраты, соединения азотной кислоты, широко применяются в производстве и промышленности благодаря своим уникальным свойствам. Один из основных способов использования нитратов - это в качестве удобрений. Нитрат калия, нитрат аммония и нитрат кальция являются основными источниками азота для растений, обеспечивающими их нормальный рост и развитие.
Кроме этого, нитраты находят применение в производстве пищевых продуктов. Нитрат натрия используется в пищевой промышленности в качестве консерванта для мяса и рыбы, так как он обладает антимикробными свойствами и способен предотвращать развитие бактерий и патогенных микроорганизмов.
Кроме того, нитраты применяются в промышленности для производства взрывчатых веществ. Нитрат аммония является одним из основных компонентов тротила – одного из самых мощных взрывчатых веществ, применяемого в горном деле и строительной отрасли.
Также нитраты находят применение в производстве стекла. Их добавление в стекловарение позволяет улучшить его химическую стойкость и прозрачность. Кроме того, нитраты могут быть использованы в процессе электрохимического полирования металлов, что позволяет получить идеально гладкую поверхность.
В итоге, нитраты являются важными соединениями, которые находят широкое применение в различных отраслях промышленности и производства. Их уникальные свойства и возможности позволяют использовать их для удобрений, консервации пищевых продуктов, производства взрывчатых веществ и улучшения качества стекла.
Экологические последствия взаимодействия нитратов с металлами

Нитраты – соединения азотной кислоты, которые часто используются в сельском хозяйстве в качестве удобрений. Взаимодействие нитратов с металлами может привести к серьезным экологическим последствиям.
Одним из основных проблемных аспектов такого взаимодействия является образование токсичных соединений. При контакте нитратов с определенными металлами, например, ртутью или свинцом, образуются нитраты данных металлов. Эти соединения могут быть опасными для живых организмов и вносят серьезный вклад в загрязнение окружающей среды.
Другим негативным последствием взаимодействия нитратов с металлами является рост водорослей в водных системах. Использование нитратов в качестве удобрений приводит к их попаданию в реки и озера. Взаимодействие нитратов с металлами в водной среде способствует росту водорослей, что приводит к образованию так называемых "зеленых вод" или "водорослевых цветений". Это явление негативно влияет на экологию водных систем и может приводить к смертельным последствиям для водных организмов.
Также взаимодействие нитратов с металлами может приводить к заражению питьевой воды. Попадание нитратов в подземные воды может привести к образованию высоких концентраций нитратов, которые затем могут попадать в питьевую воду. Употребление такой воды может негативно влиять на здоровье людей и вызывать различные заболевания.
Все эти факторы подчеркивают важность контроля и ограничения использования нитратов в сельском хозяйстве. Необходимо разработать и применять специальные технологии для обработки и очистки вод и почв от остатков нитратов и металлов, чтобы минимизировать их отрицательное воздействие на окружающую среду и здоровье людей.
Перспективы исследования взаимодействия нитратов с металлами
Взаимодействие нитратов с металлами является важной темой исследований в области химии. Оно представляет собой сложную систему реакций, которая требует глубокого понимания и тщательного изучения. Изучение взаимодействия нитратов с металлами позволяет расширить наши знания о реакционной способности металлов и их взаимодействии с другими химическими соединениями.
Перспективы исследования взаимодействия нитратов с металлами включают различные аспекты, такие как реакционные механизмы, подводные камни и потенциальные применения. Изучение реакционных механизмов позволяет получить более полное представление о процессах, происходящих при взаимодействии нитратов с металлами и предсказать результаты реакций. Познание подводных камней взаимодействия нитратов с металлами может помочь в разработке новых методов синтеза и улучшении существующих. Краткая классификация реакций, результатов и специфичных особенностей взаимодействия нитратов с металлами также может быть представлена в виде таблицы или списка для наглядности.
Исследования взаимодействия нитратов с металлами имеют практическую значимость и могут найти применение в различных областях, таких как катализ, синтез новых материалов, аналитическая химия и многое другое. Например, разработка новых катализаторов на основе нитратов металлов может привести к повышению эффективности химических реакций и снижению затрат на производство. Изучение взаимодействия нитратов с металлами открывает перспективы для создания новых материалов с заданными свойствами, которые могут найти применение в различных отраслях промышленности. Также разработка методов анализа содержания нитратов в различных средах может быть полезна для контроля качества пищевой продукции и водных ресурсов.
Вопрос-ответ

Какие металлы могут взаимодействовать с нитратами?
С нитратами могут взаимодействовать различные металлы, включая алюминий, медь, железо, свинец, цинк и другие. Каждый металл может проявлять разные особенности и реакции при взаимодействии с нитратами.
Какие реакции могут происходить при взаимодействии нитратов с металлами?
При взаимодействии нитратов с металлами может происходить ряд различных реакций. Например, нитраты могут окислять металлы, образуя оксиды. Они также могут протекать реакции с образованием нитрозных соединений или соединений с другими анионами. Кроме того, могут происходить реакции старения, при которых нитраты медленно разлагаются в результате воздействия атмосферы или других факторов.
Какие особенности могут быть связаны с взаимодействием нитратов с металлами?
При взаимодействии нитратов с металлами могут проявляться различные особенности. Например, некоторые металлы могут образовывать растворимые нитраты, которые легко реагируют с другими компонентами. Другие металлы могут образовывать нерастворимые нитраты, которые могут образовывать защитные пленки на поверхности металла и предотвращать дальнейшую коррозию. Особенности взаимодействия могут также зависеть от конкретных условий и свойств металла и нитратов.
Какие примеры взаимодействия нитратов с металлами можно привести?
Примерами взаимодействия нитратов с металлами могут быть реакции алюминия с нитратами, при которых образуются оксиды и азотные оксиды. Еще один пример - реакция меди с нитратами, при которой образуется нитрат меди(II). Имеются также множества других примеров реакций различных металлов с нитратами, каждый из которых проявляет свои особенности и характеристики.
