В химии существует много различных типов реакций, и одним из наиболее интересных и важных является реакция неорганических кислот с металлами. Это процесс, при котором кислоты взаимодействуют с металлами, образуя соли и высвобождая водород.
Основное свойство неорганических кислот, которое позволяет им реагировать с металлами, – это их способность отдавать протоны. Когда кислота вступает в контакт с металлом, происходит обмен протонами между ионами металла и кислоты. При этом металл образует положительно заряженный ион, а кислота образует отрицательно заряженный ион.
Примером реакции неорганической кислоты с металлом является реакция серной кислоты с цинком. В результате этой реакции образуется сульфат цинка и выделяется водород. Уравнение реакции выглядит следующим образом: H2SO4 + Zn = ZnSO4 + H2. Еще одним примером является реакция хлороводородной кислоты с алюминием. В результате этой реакции получается хлорид алюминия и высвобождается водород. Уравнение реакции записывается так: 2HCl + 2Al = 2AlCl3 + 3H2.
Реакция неорганических кислот с металлами

Неорганические кислоты, такие как серная, соляная и азотная, могут реагировать с металлами, образуя соли и выделяя водородный газ. Эти реакции основаны на свойствах кислоты образовывать ион гидрогена и способности металлов отдавать электроны.
Реакция кислот с металлами происходит по типу односторонней замены. Металл отдает электроны кислоте, образуя положительный ион металла, а кислота принимает эти электроны, становясь отрицательно заряженным ионом. Таким образом, металл и кислота образуют соль и водород.
Примеры реакций неорганических кислот с металлами:
- Реакция серной кислоты (H2SO4) с цинком (Zn):
- Zn + H2SO4 → ZnSO4 + H2
- Реакция соляной кислоты (HCl) с алюминием (Al):
- 2Al + 6HCl → 2AlCl3 + 3H2
- Реакция азотной кислоты (HNO3) с железом (Fe):
- 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O
Реакции кислот с металлами являются примерами реакций обмена и широко используются в химической промышленности и лабораторных исследованиях. Эти реакции имеют большое практическое значение и применяются в процессе получения солей, водорода и других химических соединений.
Основные принципы
Одним из основных принципов реакции неорганических кислот с металлами является образование солей. При контакте кислоты с металлом происходит ионный обмен, в результате которого образуются ионы металла и ионы кислоты.
В зависимости от свойств металла и кислоты, реакция может протекать с разной интенсивностью. Некоторые металлы, такие как цинк и алюминий, обладают достаточно высокой активностью и реагируют с большинством кислот. Другие металлы, например, золото или платина, сравнительно инертны и не вступают в реакцию с кислотами.
В процессе реакции металл может вытеснять из раствора другой металл, если он активнее по ряду напряжений, чем металл, находящийся в растворе. Также металл может вытеснять водород из кислоты, если он активнее водорода по ряду напряжений.
Реакция между металлом и кислотой может сопровождаться выделением газа. Например, при реакции металла с соляной кислотой образуется хлорид металла и обильно выделяется хлороводородный газ. Такое выделение газа может сопровождаться образованием пены или бурления раствора.
Взаимодействие кислот с металлами
Металлы активно реагируют с кислотами в химических реакциях, называемых кислотно-основными реакциями. При этом происходит образование солей и выделение водорода.
Когда металл вступает в реакцию с кислотой, происходит движение электронов от металла к водородному иону кислоты. В результате образуется безводный соль. Например, при реакции алюминия с соляной кислотой образуется хлорид алюминия и выделяется водород:
2Al + 6HCl → 2AlCl3 + 3H2
Реакции между кислотами и металлами можно разделить на две основные группы: реакции сильных кислот с активными металлами и реакции слабых кислот с металлами.
- Реакции сильных кислот с активными металлами: в таких реакциях происходит выделение большого количества водорода. Например, реакция хлороводородной кислоты с цинком:
2HCl + Zn → ZnCl2 + H2
- Реакции слабых кислот с металлами: в этом типе реакций выделяется небольшое количество водорода. Например, реакция уксусной кислоты с медью:
2CH3COOH + Cu → Cu(CH3COO)2 + H2
Взаимодействие кислот с металлами имеет широкое применение в различных областях, включая металлургию, электролиз и производство батареек. Кислотно-основные реакции являются важным фундаментальным понятием в химии и играют важную роль в понимании реакций и взаимодействий различных веществ.
Реакция кислородных кислот с металлами

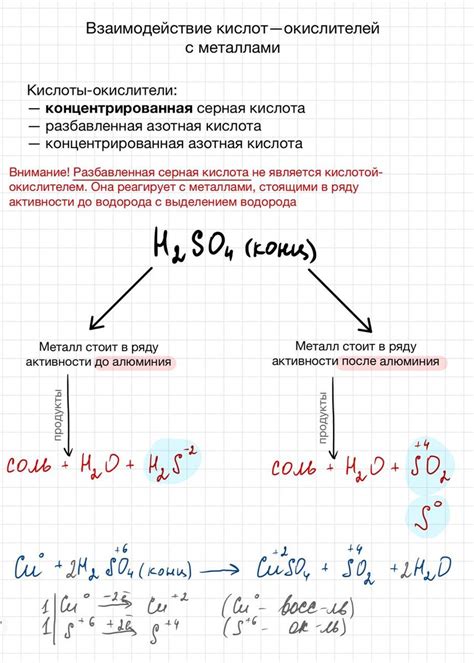
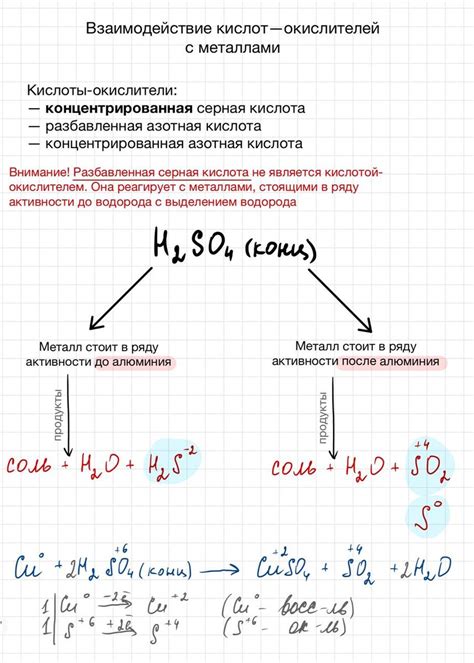
Кислородные кислоты являются одним из типов неорганических кислот, которые могут реагировать с металлами. Во время такой реакции происходит образование солей и выделение водорода.
Одним из примеров реакции кислородной кислоты с металлом является реакция серной кислоты с цинком. В результате образуется сульфат цинка и выделяется водород:
H2SO4 + Zn → ZnSO4 + H2
Также, реакция азотной кислоты с металлами приводит к образованию нитратов металлов и выделению водорода. Например, реакция азотной кислоты с медью приводит к образованию нитрата меди и выделению водорода:
HNO3 + Cu → Cu(NO3)2 + H2
Реакция кислородных кислот с металлами основана на окислительно-восстановительных свойствах кислот. В данном случае, кислородные кислоты выступают в качестве окислителей, окисляя металлы и превращая их в соли.
Реакция кислородных кислот с металлами щелочных и щелочноземельных металлов проходит с большой степенью активности. Однако, реакционная способность кислородных кислот может зависеть от их концентрации и температуры.
Принципы реакции соляных кислот с металлами
Реакция металлов с соляными кислотами основана на ионном обмене между металлом и кислотой. Соляные кислоты характеризуются наличием положительного водородного иона (H+) и отрицательного аниона, обычно хлорида (Cl-). Когда металл контактирует с соляной кислотой, ионы водорода и аниона металла обмениваются местами: водородные ионы присоединяются к металлу, а металлические ионы вступают в реакцию с анионами кислоты.
Реакция протекает следующим образом: металл распадается на ионы и реагирует с водородными ионами, образуя молекулы водорода и ионы металла. Реакция металла с соляной кислотой может быть осуществлена в разных условиях, например, при нагревании или при простом контакте металла с кислотой.
Скорость реакции соляных кислот с металлами зависит от множества факторов, таких как температура, концентрация кислоты, поверхность металла и наличие ингибиторов реакции. Более активные металлы, такие как натрий и калий, обычно реагируют с соляными кислотами более интенсивно и быстро, чем менее активные металлы, например, алюминий или цинк.
Реакция металлов с соляными кислотами может протекать с выделением газа, такого как водород, или образованием растворимых солей, таких как хлориды или сульфаты металлов. Эти реакции широко используются в химической промышленности для получения различных продуктов, а также в аналитической химии для определения наличия металлов в различных образцах.
Примеры реакции соляных кислот с металлами

Реакция соляных кислот с металлами является типичным примером реакции, происходящей между кислотами и металлами. Процесс происходит с образованием соли и выделением водорода.
Одним из примеров такой реакции является реакция соляной кислоты с цинком. При соприкосновении цинка со соляной кислотой образуется соль цинка и выделяется водород. Уравнение реакции выглядит следующим образом:
Zn + 2HCl → ZnCl2 + H2
Также может происходить реакция соляной кислоты с железом. В процессе реакции образуется соль железа (III) и выделяется водород:
Fe + 2HCl → FeCl3 + H2
Эти реакции являются классическими примерами реакций соляных кислот с металлами. В процессе реакции соляные кислоты выступают как окислители, принимая электроны от металлов, а металлы окисляются, отдавая электроны кислороду из кислоты. Такие реакции имеют большое практическое применение, например, в аналитической химии или в процессах очистки металлов.
Примеры реакции кислородных кислот с металлами

Реакции кислородных кислот с металлами являются одними из наиболее распространенных и важных примеров реакций, происходящих между неорганическими веществами. Кислородные кислоты содержат атомы кислорода, которые могут проявлять окислительные свойства и образовывать ионы водорода H+.
Одним из наиболее известных примеров реакции кислородной кислоты с металлом является реакция серной кислоты H2SO4 с цинком Zn. В результате этой реакции образуется сульфат цинка ZnSO4 и выделяется водородный газ H2.
Еще одним примером реакции является реакция азотной кислоты HNO3 с медью Cu. В результате этой реакции образуется нитрат меди Cu(NO3)2 и образуется оксид азота NO или NO2, который выделяется в виде коричневых газов.
Реакция соляной кислоты HCl с алюминием Al также является примером реакции кислородной кислоты с металлом. При этой реакции образуется хлорид алюминия AlCl3 и выделяется водородный газ H2.
Такие реакции между кислородными кислотами и металлами имеют большое значение не только в химической промышленности, но и в некоторых приложениях, таких как производство удобрений, очистка воды и другие процессы.
Вопрос-ответ

Какие вещества являются неорганическими кислотами?
Неорганическими кислотами являются вещества, содержащие в своей молекуле одну или несколько кислотных групп, таких как HCl (соляная кислота), H2SO4 (серная кислота), HNO3 (азотная кислота) и другие.
Какие принципы лежат в основе реакции между неорганическими кислотами и металлами?
Реакция неорганических кислот с металлами основана на образовании солей и освобождении молекулярного водорода. Металл замещает водород в кислотной группе, образуя соответствующую соль и выделяя водород.
Какой пример реакции неорганической кислоты с металлом можете привести?
Примером реакции неорганической кислоты с металлом является реакция соляной кислоты с цинком. При взаимодействии HCl и Zn образуется соль ZnCl2 (хлорид цинка) и выделяется водородный газ: 2HCl + Zn → ZnCl2 + H2.
Какие факторы влияют на скорость реакции между неорганической кислотой и металлом?
Скорость реакции между неорганической кислотой и металлом может зависеть от различных факторов, таких как концентрация кислоты, поверхность металла, температура и наличие катализаторов.
