Химическая реакция металлов с щелочами при нормальных условиях является одним из фундаментальных процессов в химии. В результате этой реакции, металлы реагируют с щелочами, образуя соль и выделяя водород. Реакция происходит при комнатной температуре и атмосферном давлении.
Периодическая система химических элементов содержит несколько металлов, которые демонстрируют реакцию с щелочами. Среди них можно выделить щелочные металлы - литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Эти элементы характеризуются высокой химической активностью и легкостью реакции с щелочами.
Реакция металлов с щелочными гидроксидами происходит следующим образом. Металл вступает в реакцию с водой, образуя гидроксид металла и выделяя водородный газ. Каждый щелочный металл имеет свои особенности в ходе этой реакции, что позволяет их различать и использовать в различных процессах, включая производство сплавов и химических соединений.
Описание реакции металлов с щелочами
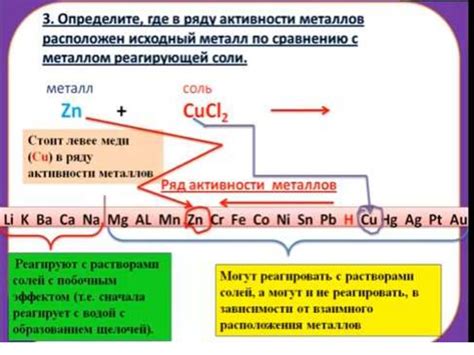
Щелочи являются химическими соединениями, которые растворяются в воде и обладают способностью образовывать гидроксиды. Реакция металлов с щелочами основана на образовании гидроксидов металлов.
При соприкосновении металлов с щелочами происходит обмен ионами – катион металла замещает гидроксидную группу в соединении щелочи, образуя гидроксид металла. Данная реакция сопровождается выделением водорода и образованием солей.
Ряд металлов, демонстрирующих реакцию с щелочами при нормальных условиях, включает активные металлы, такие как натрий (Na), калий (K), литий (Li), рубидий (Rb), цезий (Cs), а также стронций (Sr), барий (Ba) и кальций (Ca).
Реакция металлов с щелочами очень быстрая и сопровождается выделением тепла. Гидроксиды металлов, образующиеся в результате данной реакции, широко используются в различных отраслях промышленности и научных исследованиях.
Элементы, проявляющие реакцию

Щелочные металлы
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), проявляют реакцию с щелочами при нормальных условиях. Эти металлы имеют низкую электроотрицательность и активно взаимодействуют с водой, образуя щелочные растворы и выделяя водород.
Щелочноземельные металлы
Щелочноземельные металлы, включая магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), также демонстрируют реакцию с щелочами. Однако, в отличие от щелочных металлов, реакция происходит не с водой, а с гидроксидами щелочных металлов.
Алюминий
Алюминий (Al) также может проявлять реакцию с щелочами при нормальных условиях. При взаимодействии с гидроксидами щелочных металлов образуется соль алюминия и выделяется водород.
Сплавы металлов
Некоторые сплавы металлов также могут проявлять реакцию с щелочами. Один из примеров - сплав натрия и калия, который реагирует с водой, образуя гидроксиды и выделяя водород.
Заключение
Общим свойством элементов, проявляющих реакцию с щелочами при нормальных условиях, является их низкая электроотрицательность. Это позволяет им активно взаимодействовать с гидроксидами щелочных металлов или водой, образуя щелочные растворы и выделяя водород.
Список активных металлов

Активные металлы - это элементы, которые реагируют с щелочами при нормальных условиях, образуя соли и выделяя водород. Эта реакция происходит благодаря высокой реакционной способности металла, которая обусловлена его низким электроотрицательностью.
Первый элемент, который демонстрирует реакцию с щелочами, - это литий (Li). Литий активен воздухе и быстро реагирует с водой или растворами щелочей, образуя гидроксид лития и выделяя водород.
Другим примером активного металла является натрий (Na). Натрий также активен воздухе и легко реагирует с щелочами, образуя гидроксид натрия и выделяя водород. Реакция натрия с водой очень бурная и сопровождается выделением пламени и приличным количеством тепла.
Калий (K) также относится к активным металлам. Реакция калия с щелочами аналогична реакции натрия и лития. Калий реагирует с водой, образуя гидроксид калия и выделяя водород, при этом реакция может быть еще более энергичной и даже опасной.
Другие активные металлы включают рубидий (Rb) и цезий (Cs), которые реагируют с щелочами сильнее калия и имеют аналогичные реакции. Они образуют гидроксиды соответствующих металлов и выделяют водород.
Активные металлы являются важными элементами в химии и промышленности. Их реактивность обусловливает их широкое применение в производстве различных кислот, щелочей, сплавов и других соединений.
Влияние реакции на металл
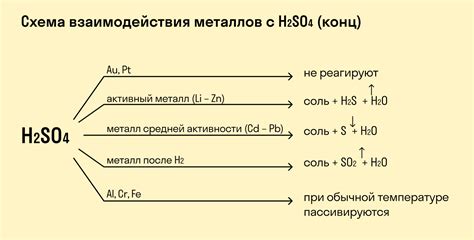
Реакция металлов с щелочами при нормальных условиях имеет значительное влияние на структуру и свойства металла. В ходе данной реакции происходит образование гидроксидов металлов, что приводит к изменению его физических и химических свойств.
Первое и наиболее заметное влияние реакции на металл – изменение его цвета. Некоторые металлы при взаимодействии с щелочами изменяют свою окраску, что может быть использовано в качестве метода идентификации металлов. Например, реакция железа с гидроксидом натрия приводит к образованию ржавчины, которая обладает характерным красноватым оттенком.
Еще одним важным влиянием реакции на металл является образование гидроксидного слоя на его поверхности. Гидроксиды металлов обладают высокой адгезией к поверхности металла и способны предотвращать дальнейшую реакцию с воздухом и влагой, что защищает металл от коррозии и окисления.
Кроме того, реакция металлов с щелочами может вызывать изменение металлического состояния металла. Например, при взаимодействии натрия с водой происходит образование гидроксида натрия и выделение водорода. При этом металл натрий растворяется и превращается в ионы натрия, что изменяет его металлическое состояние и свойства.
Таким образом, реакция металлов с щелочами является важным фактором, влияющим на структуру и свойства металлов. Она может приводить к изменению цвета, образованию защитного гидроксидного слоя и изменению металлического состояния металла, что имеет практическое значение в различных областях науки и техники.
Методы определения реактивности металлов

Металлы могут проявлять различную реактивность при взаимодействии с щелочами. Для определения реактивности металлов существуют различные методы, позволяющие оценить реакционную способность каждого металла.
Один из методов определения реактивности металлов - измерение скорости реакции с щелочами. В данном методе металлическая пластинка помещается в раствор щелочи, и измеряется время, за которое металл начинает реагировать. Чем быстрее реакция, тем более реактивен металл.
Другим методом определения реактивности металлов является использование электродного потенциала. Каждый металл имеет свой электродный потенциал, который позволяет определить его реакционную способность с щелочами. Более отрицательный электродный потенциал обозначает более реактивный металл.
Также для определения реактивности металлов может быть использована визуальная оценка реакции. В данном случае металл помещается в раствор щелочи и наблюдается, происходит ли выделение газа или образование осадка. Если реакция происходит бурно и с образованием газа, то металл можно считать реактивным.
Определение реактивности металлов является важным для понимания их свойств и возможности использования в различных химических процессах. Установление реактивности металлов позволяет определить их применимость в различных реакциях и процессах, а также помогает предсказать их взаимодействие с другими веществами и соединениями.
Практическое применение реакции металлов с щелочами
Реакция металлов с щелочами имеет широкое применение в различных сферах человеческой деятельности.
В промышленности данная реакция используется для производства металлов, таких как натрий, калий, литий и др. Полученные при этом продукты находят применение во многих областях, включая химическую, электротехническую и фармацевтическую промышленность.
Реакция металлов с щелочами также широко используется в химическом анализе для определения содержания металлов в различных образцах. Это позволяет установить наличие или отсутствие определенного металла в исследуемом материале и определить его концентрацию.
В домашнем хозяйстве реакция металлов с щелочами находит применение при использовании щелочных средств для чистки поверхностей от загрязнений. Натрий, калий и другие металлы, образующиеся в результате реакции с щелочными веществами, способны эффективно удалять жиры и другие органические вещества, делая поверхности чистыми и блестящими.
Одним из важных практических применений реакции металлов с щелочами является использование такого процесса в батареях. Батареи со щелочным электролитом, содержащие металлический катод, дают сильное и стабильное напряжение и широко применяются в таких устройствах, как фонари, пульты дистанционного управления и многие другие.
Значение реакции для химической промышленности

Реакция металлов с щелочами при нормальных условиях имеет огромное значение для химической промышленности. Эта реакция позволяет производить различные важные химические соединения, которые широко применяются в различных отраслях промышленности.
Одним из главных продуктов реакции металлов с щелочами являются гидроксиды металлов (щелочные гидроксиды), которые широко используются как основные растворители, катализаторы, а также в производстве стекла, мыла, моющих средств и других продуктов бытовой химии.
Кроме того, реакция металлов с щелочами позволяет получать металлические соли, которые находят применение в металлургии, электроиндустрии, производстве красителей, добавок для пищевой промышленности и многих других отраслях.
Реакция металлов с щелочами также используется в процессе очистки и обработки воды. Гидроксиды некоторых металлов, полученные в результате этой реакции, обладают свойством осаждать и удалять вредные примеси из воды, делая ее безопасной для использования в питьевых и технических целях.
Кроме того, реакция металлов с щелочами играет важную роль в производстве энергии. Металлические гидроксиды, получаемые в результате реакции, используются в топливных элементах и аккумуляторах, обеспечивая электрохимические процессы, необходимые для преобразования энергии.
Перспективы и дальнейшие исследования в области реакции металлов с щелочами

Реакция металлов с щелочами является одной из наиболее изученных химических реакций. В ходе этой реакции металлы вступают в химическую связь с щелочами, образуя соединения, называемые гидроксидами. Эта реакция широко применяется в различных областях, таких как промышленность, лабораторные исследования и даже повседневная жизнь.
Однако, несмотря на обширное знание о реакции металлов с щелочами, существует необходимость в дальнейших исследованиях и разработках в этой области. Важно углубить понимание механизмов этой реакции и идентифицировать новые соединения, которые можно получить при ее проведении.
Одним из основных направлений исследований может стать изучение взаимодействия различных металлов с разными типами щелочей. Возможно, в результате таких исследований будет обнаружено, что некоторые металлы претерпевают реакцию с определенными щелочами более интенсивно, что может иметь важные применения в различных областях, например, в материаловедении или катализе.
Также следует отметить, что не все воздействие металлов на щелочи происходит при нормальных условиях, исследования в области реакции металлов с щелочами при других условиях, таких как повышенная температура или давление, могут привести к открытию новых реакций или модификаций известных соединений.
В целом, исследования в области реакции металлов с щелочами имеют большой потенциал для развития и применения в различных областях науки и промышленности. Поэтому, дальнейшие исследования в этой области являются неотъемлемой частью научного прогресса и могут привести к новым открытиям и инновациям.
Вопрос-ответ

Какие элементы могут демонстрировать реакцию металлов с щелочами?
Реакция металлов с щелочами при нормальных условиях может демонстрироваться различными элементами, такими как литий (Li), натрий (Na), калий (K) и другие щелочные металлы.
Какие металлы реагируют с щелочами при нормальных условиях?
Металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), реагируют с щелочами, такими как гидроксиды натрия (NaOH), калия (KOH) и другие аналогичные соединения.
