Взаимодействие металлов с растворами солей является одной из фундаментальных тем химии. Когда металлы погружаются в растворы солей, происходят различные химические реакции, которые определяют поведение и свойства металлов в различных условиях. Это взаимодействие может привести к образованию осадков, изменению цвета растворов, электрохимическим реакциям и даже к изменению структуры металла.
Одной из наиболее известных реакций взаимодействия металлов с растворами солей является окислительно-восстановительная реакция, при которой происходит передача электронов между металлом и ионами металла в растворе. Такие реакции могут быть использованы для получения металлических покрытий на различных поверхностях или для очистки металлов.
Другим примером химической реакции является образование осадков, когда два раствора солей металлов смешиваются вместе. Это явление наблюдается, например, при взаимодействии железа с раствором серебра. Реакция может привести к образованию темно-серого отложения на поверхности металла.
Важно отметить, что свойства реакции между металлами и растворами солей зависят от многих факторов, включая концентрацию раствора, температуру, рН-уровень и наличие других веществ в растворе. Эти факторы могут сильно влиять на ход и скорость реакции, а также на получаемые продукты.
Изучение взаимодействия металлов с растворами солей имеет большое значение как с практической, так и с теоретической точки зрения. Это позволяет оптимизировать условия производства металлических материалов, разработать новые методы анализа и очистки металлов, а также расширить наши знания о фундаментальных закономерностях химических реакций.
Химические реакции металлов с растворами солей

Взаимодействие металлов с растворами солей является одной из важных химических реакций. При этом происходят различные изменения, которые зависят от химической природы металла и соли.
Обычно процесс взаимодействия металла с раствором соли сопровождается образованием осадка или прохождением реакции растворения. Например, реакция между кальцием и хлоридом меди(II) приводит к образованию осадка красной оксиды меди.
Некоторые металлы, такие как железо, могут образовывать различные ионы, взаимодействующие с раствором соли. Так, при добавлении железа в раствор медного(II) хлорида реакция протекает в два этапа: сначала образуется осадок неправильной форвы Фехнера, а затем он растворяется с образованием трехвального иона.
Следует отметить, что реакции металлов с растворами солей могут быть использованы в качестве метода анализа. Например, при определении наличия и концентрации ионов хлорида в растворе можно использовать реакцию образования белого осадка хлорида серебра при добавлении серной кислоты к раствору.
Таким образом, химические реакции металлов с растворами солей представляют собой важные процессы, которые позволяют понять особенности взаимодействия металлов с окружающей средой и используются в различных областях, включая аналитическую химию.
Влияние растворов солей на свойства металлов
Растворы солей имеют значительное влияние на свойства металлов.
Во-первых, растворы солей могут вызывать коррозию металла, то есть его разрушение при взаимодействии с окружающей средой. Это особенно заметно на поверхности металла, где образуются пятна, пузыри и покрытия. Например, растворы солей, содержащие хлор и сульфаты, способствуют коррозии железа.
Во-вторых, растворы солей могут изменять электропроводность металла. Когда металл находится в контакте с раствором соли, ионы этого раствора могут перемещаться через металл, вызывая тем самым электропроводность материала. Например, проведение электрического тока через раствор серебра может вызвать электронное осаждение серебра на поверхности другого металла.
В-третьих, растворы солей могут изменять структурные свойства металла. Когда металл погружен в раствор соли, ионы этого раствора могут встраиваться в решетку кристаллической структуры металла или образовывать комплексные соединения с металлом. Это может приводить к изменению фазового состава и механических свойств металла.
Таким образом, растворы солей имеют важное значение при изучении взаимодействия металлов с окружающей средой. Изучение этого взаимодействия позволяет предсказывать и контролировать изменения в свойствах металлов при эксплуатации или хранении их в различных условиях.
Механизм взаимодействия металлов с растворами солей

Взаимодействие металлов с растворами солей является одним из основных процессов в химии. При этом происходят химические реакции, которые приводят к изменению свойств и состояния металла и соли. Механизм этого взаимодействия может быть различным, в зависимости от типа металла и соли.
Одним из типичных механизмов взаимодействия металла с раствором соли является обмен ионами. Когда металл погружается в раствор соли, ионы металла обмениваются с ионами раствора. Например, при взаимодействии меди с раствором соли хлорида натрия, ионы натрия обмениваются с ионами меди, образуя хлорид меди.
Еще одним механизмом взаимодействия металла с раствором соли является образование комплексных соединений. В этом случае, при взаимодействии металла с раствором соли, образуются комплексные ионы, состоящие из металла и лежащих в его координационной сфере молекул соли. Например, при взаимодействии железа с раствором соли серебра, образуется комплексный ион, в котором железо окружено молекулами серебра.
Таким образом, механизм взаимодействия металлов с растворами солей включает обмен ионами и образование комплексных соединений. Эти процессы определяют химические реакции и свойства, происходящие при взаимодействии металлов с солями и играют важную роль в различных областях науки и технологий.
Окислительно-восстановительные реакции металлов с солями
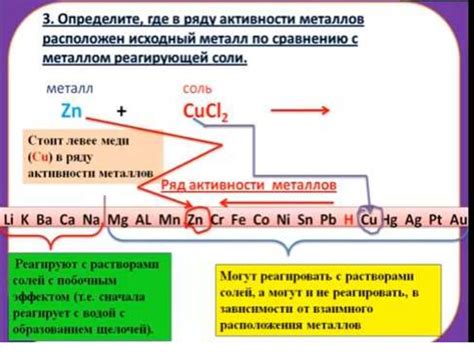
Окислительно-восстановительные реакции являются механизмом химической реакции, при котором происходит обмен электронами между реагирующими веществами. К таким реакциям относится взаимодействие металлов с солями. В ходе таких реакций металлы могут проявлять свою окислительную или восстановительную активность.
Если металл обладает более высокой окислительной активностью, то он сможет вытеснить из раствора ион другого металла, проявляя свою восстановительную активность. В результате такой реакции происходит образование соответствующего металлического отложения, а ион восстановленного металла присоединяется к соли, которая становится солью восстановленного металла.
Например, медь обладает большей восстановительной активностью, чем железо, поэтому при взаимодействии меди с раствором соли железа происходит окислительно-восстановительная реакция, в результате которой образуется медь в металлической форме, а ион железа присоединяется к соли меди, образуя соль железа.
Следует отметить, что окислительно-восстановительные реакции металлов с солями являются важными с точки зрения применения в различных отраслях промышленности. Так, например, процесс гальванизации основан на окислительно-восстановительных реакциях металлов, которые позволяют создавать защитные покрытия на поверхности деталей из разных металлов.
Образование осадков в результате взаимодействия металлов с растворами солей

При взаимодействии металлов с растворами солей может происходить образование осадков. Осадки являются нестабильными соединениями и образуются в результате химической реакции между металлом и солью.
При этом происходит обмен ионами между металлом и солью. В растворе металл может переходить в ионное состояние, а ионы соли могут соединяться с ионами металла, образуя осадок.
Образование осадков может быть вызвано различными факторами, такими как изменение pH раствора, наличие в растворе примесей или концентрации соли. Реакция образования осадка может быть эндотермической или экзотермической в зависимости от условий.
В результате образования осадка происходит изменение физических свойств раствора. Осадок может быть виден невооруженным глазом как мутность или отдельные частицы в растворе. Он также может оседать на дне емкости с раствором или образовывать накипь на поверхности.
Образование осадков при взаимодействии металлов с растворами солей имеет широкое применение в различных областях, таких как аналитическая химия и производство материалов. Понимание процессов образования осадков является важным для контроля и оптимизации химических реакций и процессов, использующих эту реакцию.
Коррозия металлов под влиянием солевых растворов

Коррозия металлов - это процесс разрушения металлических материалов под воздействием окружающей среды. Соловые растворы могут быть одной из причин коррозии, особенно если в них содержатся агрессивные и окислительные соединения.
Под влиянием солевых растворов металлы могут проявлять различные реакции. Например, активные металлы, такие как цинк или алюминий, могут растворяться в растворах кислотных солей. Кислота обеспечивает необходимую окислительную среду для реакции, а соль усиливает процесс растворения металла. В результате таких реакций металлы могут образовывать оксиды, гидроксиды и соли.
Другие металлы могут проявлять противоположную реакцию и образовывать защитную пленку на своей поверхности при взаимодействии с солевыми растворами. Такая пленка может защищать металл от коррозии, так как предотвращает дальнейшее взаимодействие с раствором. Однако, если пленка повреждается или разрушается, металл снова становится подвержен коррозии.
Коррозия металлов под влиянием солевых растворов может приводить к ухудшению их физических и механических свойств. Например, металлические конструкции могут становиться менее прочными и устойчивыми к нагрузкам. Коррозия также может вызывать изменение внешнего вида и цвета металлической поверхности.
Вопрос-ответ

Какие металлы реагируют с растворами солей?
С растворами солей реагируют различные металлы, включая активные металлы, такие как натрий, калий, литий, и менее активные металлы, такие как железо, медь, цинк. Реакция может происходить как с положительно заряженными ионами металлов, так и с отрицательно заряженными ионами, образующими кислотные растворы.
Какие химические реакции могут происходить между металлами и растворами солей?
Между металлами и растворами солей могут происходить различные химические реакции, например, образование осадка, выделение газа, окисление и восстановление металла. Некоторые металлы могут проявлять свою активность и реагировать с растворами быстро и интенсивно, в то время как другие металлы могут проявлять небольшую или отсутствующую реакцию.
