Реакции металлов с кислотами являются одним из основных процессов в химии. Они происходят при взаимодействии металлических элементов с различными кислотными соединениями, такими как соляная кислота, серная кислота и азотная кислота. Эти реакции играют важную роль в промышленности и в повседневной жизни.
Основой механизма реакций металлов с кислотами является передача электронов от металла к кислоте. В результате этой реакции происходит образование ионов металла и ионов водорода. Для металлов, которые находятся в группе активных металлов, таких как натрий и калий, реакция происходит очень быстро и с выделением большого количества газа в виде пузырьков.
Важно отметить, что реакции металлов с кислотами могут быть различными. Некоторые металлы, такие как золото и платина, не реагируют с кислотами вообще. Другие металлы, такие как железо и медь, реагируют только с определенными кислотами. Иногда реакция металлов с кислотами может протекать с образованием более сложных продуктов, таких как соли металлов и кислот.
Знание механизмов реакций металлов с кислотами позволяет не только лучше понять основы химии, но и применить этот процесс на практике. Реакция металлов с кислотами широко применяется в различных областях, включая производство батарей, очистку воды и производство промышленных соединений.
Металлы и их взаимодействие с кислотами
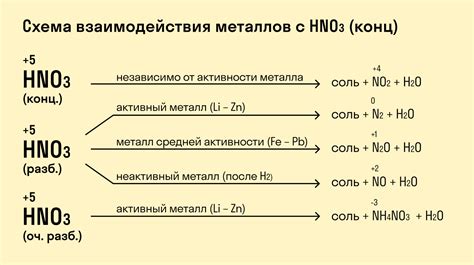
Металлы обладают удивительным свойством взаимодействовать с кислотами. Их активность в реакции с кислотой зависит от их электрохимической активности, которая определяется их положением в ряду напряжений металлов. Некоторые металлы, такие как натрий, калий и литий, очень реактивны и быстро реагируют с кислотами, выделяя газ и образуя соли.
Реакция металла с кислотой может протекать по различным механизмам, в зависимости от условий и типа кислоты. Например, при реакции с сильной минеральной кислотой, такой как соляная кислота, металл может прямо растворяться в кислоте, образуя соли и выделяя газ. При этом, образовавшаяся соль может находиться в растворенном состоянии или образовывать осадок.
Однако, не все металлы реагируют с кислотами одинаково. Например, более реактивные металлы, такие как магний и цинк, реагируют даже с более слабыми кислотами, такими как уксусная кислота. Они способны вытеснять ион водорода из кислоты и образовывать соль.
В реакции некоторых металлов с кислотами может образовываться ненормальный или водородное напряжение. Это происходит, когда металл образует соединение с кислородом из воды, что приводит к освобождению водорода. Это явление можно наблюдать при реакции цинка с кислотой сероводорода или соляной кислотой.
Металлы также могут реагировать с кислотами аномально при растворении в которых присутствует кислород. Например, латунь (сплав меди и цинка) реагирует с соляной кислотой в присутствии кислорода и образует зеленый осадок, который состоит из хлорида меди(II) и оксида никеля.
Таким образом, каждый металл имеет свои особенности взаимодействия с кислотами и может проявлять разные реакции. Понимание этих механизмов реакций металлов с кислотами позволяет углубить знания о химических процессах и применять их в различных областях, таких как промышленность и научные исследования.
Реакции металлов с кислотами: общая информация

Реакции металлов с кислотами являются важным разделом химии и нашли широкое применение в различных технологических процессах и промышленности. Кислоты обладают способностью отдавать протоны, а металлы обладают способностью образовывать ионные соединения с протонами кислоты. В результате реакций образуются соли металлов и соответствующие газы.
Основными металлами, реагирующими с кислотами, являются активные металлы, такие как натрий (Na), калий (K), кальций (Ca) и магний (Mg). Реакции этих металлов с кислотами протекают очень интенсивно и сопровождаются выделением большого количества газов. Например, реакция натрия с соляной кислотой приводит к выделению водорода и образованию хлорида натрия.
Также реакции металлов с кислотами могут происходить под воздействием окислителей. Окислитель способствует ускорению реакции, так как принимает на себя электроны, освобожденные при окислении металла. Это позволяет более интенсивно проходить реакция металла с кислотой и образованию соответствующих солей.
Важно отметить, что некоторые металлы, такие как железо (Fe) и цинк (Zn), не реагируют с обычными кислотами, такими как соляная кислота или уксусная кислота. Однако они могут реагировать с более сильными кислотами, например, с концентрированной серной кислотой.
Реакции металлов с кислотами имеют важное практическое значение и используются в различных отраслях промышленности, включая производство химических веществ, гальванических элементов и многих других. Знание механизмов этих реакций помогает предсказывать и контролировать химические процессы и способствует разработке новых технологий и материалов.
Механизмы реакций металлов с кислотами

Механизм реакции металлов с кислотами представляет собой последовательность этапов, в результате которых происходит образование соли и выделение газа. Основными механизмами таких реакций являются окислительно-восстановительные и протолитические процессы.
Окислительно-восстановительные реакции происходят при взаимодействии металла с кислородом в составе кислоты. Кислород в данном случае выступает в качестве окислителя, а металл – в качестве восстановителя. При этом металл отдает электроны кислороду, который при присоединении к водороду образует молекулу воды. Таким образом, происходит окисление металла и восстановление кислорода.
Протолитические реакции основываются на том, что кислоты диссоциируют в воде, образуя ионы водорода. В результате взаимодействия металла с водородными ионами происходит образование соли и выделение газа. Например, при взаимодействии цинка с соляной кислотой кислотные ионные пары обмениваются местами, образуя соль цинк хлорида и молекулы водорода.
Некоторые металлы, например, железо или алюминий, имеют достаточно низкую активность для реакции с кислотами. Для их активации используют более сильные окислители, такие как перманганат калия или хлорная кислота. Это позволяет проводить реакцию между металлом и кислотой даже в случае, когда она сама по себе не происходит.
Вывод: механизмы реакций металлов с кислотами включают в себя окислительно-восстановительные и протолитические процессы. Понимание этих механизмов позволяет объяснить, почему некоторые металлы реагируют с кислотами, а другие – нет, а также выбрать подходящие условия для проведения реакции.
Вопрос-ответ

Какие механизмы реакций металлов с кислотами существуют?
Существуют следующие механизмы реакций металлов с кислотами: обмен протонами, образование комплексов и обмен электронами. Какой механизм преобладает, зависит от конкретных условий реакции.
Как происходит реакция металлов с кислородными кислотами?
При реакции металлов с кислородными кислотами обычно происходит обмен протонами. Металл отдает электроны, образуется ион металла, который соединяется с кислородом из кислородной кислоты. В результате образуется соль и выделяется водород.
Что происходит при реакции щелочных металлов с водой?
При реакции щелочных металлов с водой происходит образование гидроксидов металла и выделение водорода. Механизм этой реакции связан с обменом электронами между металлом и водой.
