Металлы - важная часть нашей повседневной жизни, используемые в различных отраслях промышленности. Однако металлы обладают способностью реагировать с кислородом, что может вызывать негативные последствия. В этой статье мы рассмотрим особенности реакции металлов с кислородом, а также представим формулы этих реакций.
Реакция металлов с кислородом - это окислительно-восстановительная реакция, в результате которой возникают оксиды металлов. В данной реакции металлы отдают свои электроны кислороду, что приводит к образованию ионов оксидов металлов. Формулы этих реакций могут быть представлены следующим образом:
2M + O2 → 2MO
где M представляет металл. Эта формула показывает, что в реакции один атом кислорода соединяется с двумя атомами металла, образуя соответствующий оксид металла.
Важно отметить, что разные металлы реагируют с кислородом по-разному. Некоторые металлы, такие как натрий и калий, сильно реагируют с кислородом, при этом выделяется большое количество тепла и света. Другие металлы, такие как алюминий и железо, реагируют с кислородом более медленно и образуют менее яркие оксиды.
Металлы и их действие с кислородом
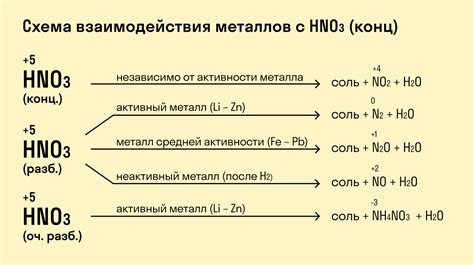
Металлы - это химические элементы, обладающие высокой электропроводностью, блеском и способностью образовывать ионы. Одним из самых распространенных взаимодействий металлов является их реакция с кислородом.
Реакция металлов с кислородом может происходить по разным механизмам, в зависимости от свойств самого металла. Например, некоторые металлы способны гореть на воздухе, образуя соединения с кислородом. Такие реакции называются окислительными или "сгоранием" металлов. Примерами металлов, образующих оксиды при воздействии кислорода, являются магний, алюминий и железо.
Другие металлы, такие как золото и платина, не реагируют с кислородом в нормальных условиях и сохраняют свою блеск и химическую стабильность. Это свойство называется инертностью металлов по отношению к кислороду.
Реакция металлов с кислородом может протекать как при высоких температурах (например, при нагревании металла), так и при нормальных условиях окружающей среды. При этом, реакция может приводить к образованию оксидов металлов или кислородных соединений металлов с другими элементами.
Важно отметить, что реакция металлов с кислородом имеет большое значение в промышленности и науке. Она используется для получения различных веществ, включая металлические оксиды, перекиси водорода и другие химические соединения. Кроме того, реакция металлов с кислородом играет важную роль в организме живых организмов, участвуя в дыхании и метаболических процессах.
Процесс окисления металлов

Окисление металлов представляет собой химическую реакцию, при которой металлы вступают во взаимодействие с кислородом. В результате этой реакции образуется оксид металла. Оксиды металлов – это химические соединения, в которых атомы металла соединены с атомами кислорода.
Процесс окисления металлов происходит при воздействии на них кислорода из воздуха или при взаимодействии с кислородсодержащими соединениями, такими как вода или кислоты. В результате окисления металлы могут менять свой цвет, становиться покрытыми оксидной пленкой или даже полностью растворяться.
Оксиды металлов различаются по своим свойствам. Некоторые оксиды металлов обладают сильной щелочностью, поэтому их называют основными оксидами. Другие оксиды металлов обладают кислотностью и называются кислотными оксидами. Оксиды металлов могут быть и амфотерными, то есть они могут проявлять как кислотные, так и щелочные свойства, в зависимости от условий реакции.
Процесс окисления металлов можно проиллюстрировать на примере реакции железа с кислородом. Железо при взаимодействии с кислородом окисляется и превращается в оксид железа. Данная реакция имеет следующую химическую формулу: 4Fe + 3O2 → 2Fe2O3. В результате реакции образуется оксид железа (III), который является основным оксидом.
Образование оксидов металлов
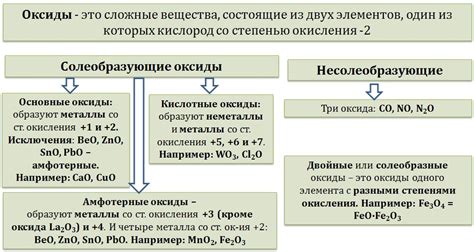
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Они образуются при реакции металлов с кислородом воздуха или воды. Образование оксидов металлов является одним из основных процессов, происходящих в природе и в химической промышленности.
Этот процесс может происходить при обычной температуре и давлении или при нагревании металла. Реакция образования оксида металла обычно сопровождается выделением тепла и света. При этом образуется оксид, который имеет характерные физические и химические свойства.
Образование оксидов металлов является важным процессом во многих технологических процессах. Например, оксиды железа (Fe2O3) широко применяются в производстве стали и красок. Алмазы, рубины и сапфиры - это разновидности оксидов алюминия.
Образование оксидов металлов также играет важную роль в качестве защитного слоя для металлов. Некоторые металлы, такие как алюминий и цинк, образуют оксидную пленку на поверхности, которая предотвращает дальнейшую коррозию и обеспечивает долговечность изделий из этих материалов.
Взаимодействие кислорода с оловом и железом
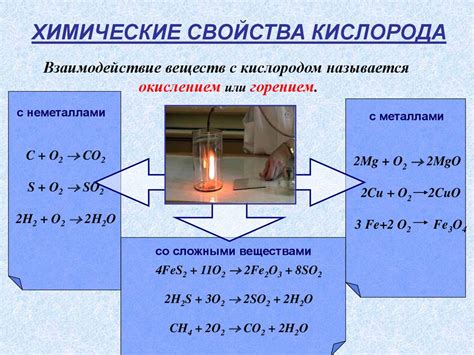
Олово является химическим элементом из группы углерода и кремния в периодической системе. При взаимодействии с кислородом, олово формирует оксиды со степенями окисления +2 и +4, но основной оксид олова имеет формулу SnO2 и называется станнином. Станнин обладает кристаллической структурой и обычно имеет безцветный или желтоватый цвет. Он не растворяется в воде и сильных кислотах, но растворяется в щелочах.
Железо также способно взаимодействовать с кислородом, образуя оксиды различных степеней окисления. Наиболее распространенным оксидом железа является Fe2O3, известный как ржавчина. Он имеет красно-коричневый цвет и образуется при окислении железа воздухом или водой. Ржавчина служит защитным слоем на поверхности объектов из железа, предотвращая дальнейшую коррозию.
Взаимодействие кислорода с оловом и железом является химической реакцией, при которой образуются соответствующие оксиды. Эти реакции являются нереверсивными и сопровождаются выделением энергии в виде тепла. Они особенно значимы в промышленности и технологии, где металлы используются для создания различных материалов и изделий.
Роль кислорода в химических реакциях

Кислород играет важную роль во множестве химических реакций, особенно при взаимодействии с металлами. Он является одним из самых химически активных элементов и может значительно изменить свойства металлов при их окислении.
Процесс окисления металла заключается в передаче электронов от металла к кислороду. При этом кислород становится окислителем, а металл — веществом, подвергшимся окислению. Эта реакция позволяет образовать различные оксиды металлов, которые могут иметь разную степень окисления и химические свойства.
Кроме того, кислород может быть вовлечен в реакции образования кислородных соединений металлов, таких как гидроксиды и пероксиды. В этих реакциях кислород связывается с металлом, образуя стабильные частицы, способные вступать в другие химические взаимодействия.
Важно отметить, что реакции металлов с кислородом могут происходить с различной интенсивностью в зависимости от условий, таких как температура, давление и наличие катализаторов. Например, некоторые металлы реагируют с кислородом только при высоких температурах или в присутствии специальных веществ, ускоряющих химическую реакцию.
Исследование реакций металлов с кислородом имеет большое практическое значение, так как позволяет оптимизировать процессы производства металлических материалов и разработать новые технологии. Кроме того, понимание роли кислорода в химических реакциях помогает объяснить множество явлений, связанных с коррозией и образованием окисных пленок на металлических поверхностях.
Свойства оксидов металлов
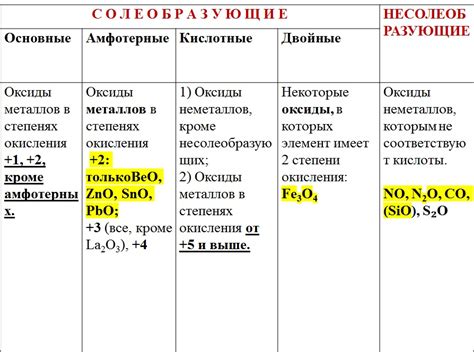
Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Они обладают рядом свойств, которые делают их важными в различных областях науки и промышленности.
Автоокисляемость. Многие оксиды металлов, особенно активные металлы, являются окислителями и могут взаимодействовать с другими веществами, освобождая кислород и окисляя их. Это свойство широко используется в различных химических процессах.
Щелочность. Многие оксиды металлов обладают щелочными свойствами и могут растворяться в воде, образуя гидроксиды металлов. Это свойство позволяет использовать оксиды металлов в производстве щелочей и различных соединений.
Проводимость. Оксиды некоторых металлов обладают электрической проводимостью. Это свойство является основой для создания электролитов, используемых в различных типах аккумуляторов и гальванических элементов.
Термостабильность. Многие оксиды металлов обладают высокой термической стабильностью и могут выдерживать высокие температуры без разложения. Это свойство делает их полезными в производстве огнеупорных материалов и керамики.
Цветность. Оксиды некоторых металлов обладают яркими цветами, что делает их интересными для использования в производстве красителей, пигментов и керамики. Различные оксиды металлов дают разные оттенки, что позволяет получать широкую цветовую гамму.
Оксиды металлов имеют широкий спектр свойств и применений, что делает их важными и интересными объектами изучения в химии и материаловедении.
Применение оксидов металлов в промышленности

Оксиды металлов широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам и химической активности. Они являются важными сырьевыми материалами для производства различных продуктов и веществ.
Одним из основных сфер применения оксидов металлов является производство красок и пигментов. Оксиды металлов обладают яркими и стойкими цветами, благодаря чему они используются для окрашивания различных материалов. Например, оксид железа (III) применяется для получения красного цвета, оксид хрома - для зеленого цвета, оксид кобальта - для синего цвета.
Оксиды металлов также используются в качестве катализаторов в различных химических реакциях. Они способны ускорить химическую реакцию и повысить ее эффективность. Например, оксид алюминия используется в производстве катализаторов для процессов гидрокрекинга нефти и газового каталитического крекинга, а оксиды рутия и платины применяются в катализаторах для производства аммиака и синтеза метанола.
Оксиды металлов также находят применение в производстве стекла и керамики. Они играют важную роль в формировании структуры материала и придают ему определенные свойства. Например, оксид титана используется для придания стеклу прозрачности и устойчивости к ультрафиолетовому излучению, оксид цинка - для улучшения прозрачности и твердости стекла.
Оксиды металлов также применяются в производстве электронной техники. Они используются в качестве полупроводниковых материалов и служат для создания различных элементов электронных устройств. Например, оксид кремния применяется в производстве микроэлектроники и солнечных батарей, оксид индия - для создания тонкопленочных транзисторов и дисплеев.
Таким образом, оксиды металлов являются важными сырьевыми материалами для промышленности и находят широкое применение в производстве различных продуктов и веществ, благодаря своим уникальным свойствам и химической активности.
Вопрос-ответ

Какие металлы реагируют с кислородом?
С кислородом реагируют различные металлы, но самыми известными и активными являются щелочные и щелочноземельные металлы. Они вступают в реакцию с кислородом атмосферы, образуя оксиды металлов.
Какие соединения образуются при реакции металлов с кислородом?
При реакции металлов с кислородом обычно образуются оксиды металлов. Например, натрий вступает в реакцию с кислородом атмосферы и образует оксид натрия (Na2O), а магний образует оксид магния (MgO).
Почему металлы реагируют с кислородом?
Металлы реагируют с кислородом из-за их химической активности и стремления заполнить последнюю энергетическую оболочку электронами. Кислород - очень электроотрицательный элемент, а металлы обладают низкой электроотрицательностью. Поэтому они образуют ионы, чтобы достичь стабильного состояния.
