Металлы – это особый класс элементов, обладающих высокой электропроводностью и термической проводимостью. В связи с этим, металлы активно участвуют в химических реакциях, образуя различные соединения. Реакция металлов с другими веществами может быть очень разнообразной и зависит от многих факторов, таких как химическая активность элемента, окружающая среда, температура и другие условия.
Одной из основных схем реакции металлов является ионный обмен. В этом типе реакции, металл отдает электроны и образует положительный ион, который затем соединяется с отрицательно заряженным ионом другого вещества, образуя ионное соединение. Например, при реакции меди с серной кислотой образуется ионное соединение меди (II) сульфат.
Еще одной распространенной схемой реакции металлов является окислительно-восстановительная реакция. В этом типе реакции, металл окисляется, т.е. отдает электроны, а другое вещество восстанавливается, т.е. принимает электроны. Например, при реакции цинка с серной кислотой цинк окисляется, образуя цинковые ионы, а серная кислота восстанавливается до сернистой кислоты.
Активность металлов: классификация

Металлы обладают разной степенью активности, которая зависит от их способности взаимодействовать с кислородом и другими химическими веществами. Активность металлов может быть классифицирована на основе их возможности окисляться и вступать в реакции с другими веществами.
Существует несколько классификаций активности металлов. Одна из них основана на электрохимическом потенциале металлов. Чем выше электрохимический потенциал, тем активнее металл. В соответствии с этой классификацией, металлы делят на активные и неметаллические.
Активные металлы, такие как калий, натрий, магний и алюминий, обладают высокой активностью и вступают в реакции с кислородом и водой. Они активно окисляются и образуют соли. Некоторые из них имеют высокую металлическую активность и используются в различных промышленных процессах и производстве.
Неметаллические металлы, такие как золото, серебро и платина, обладают низкой активностью и не взаимодействуют с кислородом и водой. Они обычно не окисляются и находят широкое применение в ювелирном и электронном производстве.
Интенсивная реакция с кислородом
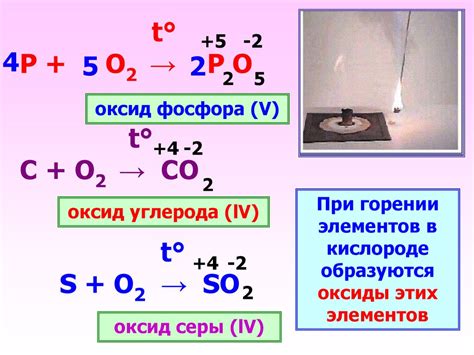
Реакция металлов с кислородом - обычное явление, которое приводит к образованию оксидов. Некоторые металлы, в особенности щелочные металлы, реагируют с кислородом очень интенсивно. При этом происходит горение металла. Например, калий и натрий при контакте с кислородом сильно пылают, образуя оксиды металла, в результате чего возникают яркие пламенные вспышки.
Оксиды, образующиеся при интенсивной реакции металлов с кислородом, имеют специфические свойства. Например, оксид калия (K2O) является крайне реактивным и способен быстро реагировать с водой, образуя гидроксид калия (KOH). Гидроксид калия обладает щелочными свойствами и широко используется в химической промышленности.
Интенсивная реакция металлов с кислородом имеет практическое применение. Например, калий и натрий используются в качестве катализаторов при сжигании отходов. Катализаторы способствуют более полному сгоранию отходов, что позволяет более эффективно использовать ресурсы и снизить вредные выбросы. Кроме того, интенсивная реакция с кислородом может использоваться в пиротехнике для создания ярких огней, взрывов и пиротехнических изделий.
Образование металлических оксидов
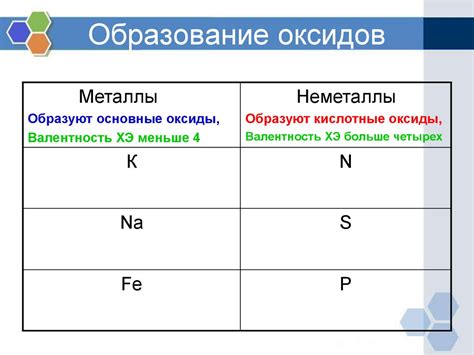
Металлические оксиды образуются в результате реакции металла с кислородом. Этот процесс может происходить при обычных условиях температуры и давления, а также в процессе нагрева и горения. Образование оксидов является одним из важных процессов в химии металлов и широко используется в различных технологических процессах.
Металлические оксиды обладают различными свойствами, в зависимости от химического состава и структуры. Они могут быть кислыми, основными или нейтральными. Кислые оксиды образуются при реакции металла с кислородом в кислой среде. Они способны реагировать с водой и образовывать кислоты. Основные оксиды образуются в щелочной среде и обладают щелочными свойствами. Нейтральные оксиды не обладают кислотными или основными свойствами и могут реагировать только с кислородом.
Образование металлических оксидов обусловлено энергетическими условиями и свойствами металлов. Некоторые металлы, такие как натрий или калий, реагируют с кислородом уже при обычных условиях температуры. Другие металлы требуют нагрева или дополнительных условий, чтобы произойти реакцию. Кроме того, степень реакции и образование оксида зависят от концентрации кислорода и плотности металла.
Коррозия металлов: причины и виды

Коррозия металлов является распространенным и серьезным явлением, которое происходит под воздействием окружающей среды. Процесс коррозии приводит к постепенному разрушению металлической поверхности и может причинить значительный ущерб различным объектам, включая инфраструктуру, автомобили и металлическую сборку.
Причины коррозии металлов связаны с химическими реакциями, происходящими между металлом и окружающей средой. Основным фактором, который стимулирует коррозию, является взаимодействие металла с кислородом в воздухе. При этом происходит окисление металла, что приводит к образованию оксидов или гидроксидов.
Виды коррозии металлов могут быть разнообразными. Одним из самых распространенных является поверхностная коррозия, которая вызывает образование ржавчины. Другим типом коррозии является межкристаллитная коррозия, которая происходит в зазорах и порах в металле.
Коррозия металлов может быть также связана с электрохимическими процессами, такими как гальваническая коррозия. При этом два разных металла находятся в электрическом контакте, создавая токовый потенциал и появление коррозии на одном из металлов.
Борьба с коррозией металлов включает в себя использование защитных покрытий, таких как краска или специальные покрытия, которые предотвращают взаимодействие металла с окружающей средой. Также применяются методы катодной защиты, при которых создается электрический ток, направленный на защиту металла от коррозии.
Химическая реакция с окружающей средой

Химическое взаимодействие металлов с окружающей средой играет важную роль в различных процессах и явлениях. Реакции металлов с веществами окружающей среды могут приводить к образованию различных соединений, изменению свойств материала или даже его разрушению.
Окисление металлов является одной из самых распространенных химических реакций, которая происходит с участием кислорода из воздуха. При окислении металлов на поверхности образуется оксид, который может приводить к образованию пленки или слоя, защищающего металл от дальнейшего окисления. Некоторые металлы, такие как алюминий и цинк, образуют пассивную окисленную пленку, которая предотвращает их дальнейшую коррозию.
Коррозия металлов — процесс их разрушения под действием агрессивных веществ окружающей среды. Вода, влажность, кислоты, щелочи, соли и другие вещества могут вызывать коррозию различных металлов. Коррозия может приводить к изменению формы и размеров металла, появлению трещин, образованию отложений и пятен на поверхности. Для защиты металлов от коррозии применяют различные методы, такие как покрытие защитным слоем, использование антикоррозионных составов или изоляция от воздействия агрессивных сред.
Реакция металлов с водой также является важным процессом. Некоторые металлы, например натрий и калий, реагируют с водой, образуя соответствующие гидроксиды и выделяя водород. Другие металлы, такие как железо и алюминий, реагируют с водой только при наличии кислорода, образуя оксиды или гидроксиды.
Электрохимическая коррозия

Электрохимическая коррозия – это процесс, при котором металл подвергается разрушающему воздействию окружающей среды. Этот процесс основан на перемещении электронов между металлом и раствором, что приводит к разрушению металлической структуры.
Коррозия является результатом окислительно-восстановительных реакций между металлом и окружающей средой. При этом на металле образуется анодная область, где происходит потеря электронов, и катодная область, где происходит восстановление электронов. Таким образом, коррозия представляет собой электрохимическую реакцию.
Один из факторов, влияющих на скорость электрохимической коррозии, - это разность потенциалов между анодом и катодом. Чем больше эта разность, тем быстрее происходит коррозия. Кроме того, на скорость коррозии влияют такие факторы, как концентрация окружающего раствора и его состав, температура, наличие примесей и т.д.
Для защиты от электрохимической коррозии применяют различные методы, включая использование антикоррозионных покрытий, анодной и катодной защиты, легирование металлов и др. Однако, ни один из этих методов не является абсолютно надежным, и поэтому предотвращение коррозии остается одной из основных задач в области материаловедения и металлургии.
Вопрос-ответ

Какие схемы реакций металлов существуют?
Существует несколько основных схем реакций металлов, включая окисление, растворение, образование сплавов и реакцию с кислотами.
Как происходит окисление металлов?
Окисление металлов - это процесс, при котором металл взаимодействует с кислородом, образуя оксид металла. Это реакция восстановления для кислорода и окисления для металла.
