Реакция металла восстановителя и кислорода является одной из фундаментальных химических реакций, которая играет важную роль во многих областях науки и техники. Эта реакция происходит при контакте металла с кислородом, что приводит к окислению металла и образованию оксида.
Основными этапами реакции металла восстановителя и кислорода являются окисление металла и восстановление кислорода. При окислении металла происходит потеря электронов, а при восстановлении кислорода - его приобретение. Эти два процесса взаимосвязаны и являются основой для различных химических реакций и превращений.
Реакция металла восстановителя и кислорода имеет широкое применение в различных отраслях науки и техники. Она используется, например, в процессе производства металлов, в химическом анализе и синтезе соединений, в энергетике и во многих других областях. Благодаря этой реакции возможно получение металлических оксидов, которые имеют важное применение как конструкционные материалы, катализаторы и электроды.
В заключение, реакция металла восстановителя и кислорода является важным химическим процессом, который имеет широкое применение в различных областях науки и техники. Понимание основных этапов этой реакции позволяет улучшить и оптимизировать множество технических процессов и создавать новые материалы с уникальными свойствами.
Основные понятия
Реакция металла восстановителя и кислорода - это химическая реакция, в которой металл восстанавливается, а кислород окисляется.
Восстановитель - вещество, способное отдавать электроны и при этом само окисляться. В процессе реакции восстановитель теряет электроны и претерпевает окисление.
Кислород - окислитель в реакции, то есть вещество, способное принимать электроны и при этом само восстанавливаться. Кислород играет важную роль во многих процессах окисления, таких как горение или дыхание.
Окисление - процесс, при котором вещество теряет электроны и приобретает положительный заряд. Это происходит в результате взаимодействия вещества с окислителем.
Восстановление - противоположный процесс окисления, при котором вещество приобретает электроны и образует отрицательный заряд. Восстановитель передает свои электроны реагирующему веществу, что приводит к его восстановлению.
Реакция металла восстановителя и кислорода находит широкое применение в различных областях, включая промышленность и лабораторную практику. Она используется для получения металлов из их оксидов, в процессе сварки и легирования металлов, а также в процессе дыхания организмов, включая человека.
Химическая реакция

Химическая реакция представляет собой процесс превращения одного или нескольких веществ в другие в результате взаимодействия их атомов или молекул. Основными этапами химической реакции являются начальные вещества (реагенты), промежуточные стадии и конечные продукты.
В реакции между металлом восстановителем и кислородом происходит передача электронов от металла к кислороду. Металл в этой реакции выступает в роли восстановителя, а кислород - в роли окислителя. При этом образуются оксиды металла, которые являются конечными продуктами реакции.
Применение реакции между металлом восстановителем и кислородом широко распространено. Например, при горении металла в присутствии кислорода образуется тепло и свет, что используется в процессе сварки или при работе с огнетушителями. Кроме того, реакция металла и кислорода является основой процесса коррозии, при котором металл окисляется в присутствии кислорода и образует оксиды, что может привести к повреждению металлических конструкций или изделий.
Металлы восстановители

Металлы восстановители - это группа элементов, которые обладают способностью передавать электроны другим веществам. Они способны вступать в реакцию с кислородом, что приводит к его восстановлению. Такие реакции реализуются в присутствии кислорода или оксидов, а металлы действуют в качестве активных веществ, катализаторов или реактивов.
Металлы восстановители широко используются в различных отраслях промышленности. Например, они применяются в электрохимии для получения металлов, в химическом производстве для восстановления окислов и производства водорода, а также в пищевой промышленности для стабилизации продуктов и предотвращения окисления.
Примерами металлов восстановителей являются: цинк (Zn), железо (Fe), алюминий (Al), магний (Mg), никель (Ni) и другие. Каждый из них имеет свои особенности и области применения. Например, цинк используется для защиты металлических поверхностей от коррозии, а железо широко применяется в железнодорожной и автомобильной промышленности.
Металлы восстановители играют важную роль в химии и технологии, обеспечивая возможность проведения реакций восстановления и получения необходимых продуктов. Их эффективное использование помогает сэкономить ресурсы, повысить производительность и улучшить качество продукции.
Взаимодействие с кислородом
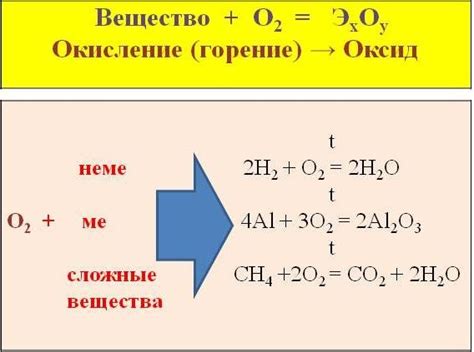
Взаимодействие металлов с кислородом является важной реакцией в химии. Кислород является сильным окислителем и может принимать электроны от металлов, вызывая их окисление. Реакция металла с кислородом может протекать в разных условиях и иметь различные особенности.
Одним из основных способов взаимодействия металлов с кислородом является горение. В этом случае металл реагирует с кислородом воздуха, образуя оксид металла и выделяя значительное количество тепла. Некоторые металлы, такие как магний и алюминий, обладают высокой способностью гореть на воздухе, что делает их полезными для использования в пиротехнике и промышленности.
Кроме горения, металлы могут реагировать с кислородом в водных растворах или при нагревании в сильно окисляющей среде. В таких условиях, в зависимости от свойств металла и условий реакции, могут образовываться различные соединения, такие как оксиды, гидроксиды или пероксиды. Например, алюминий при высоких температурах окисляется до алюминиевого оксида, а натрий взаимодействует с кислородом в водном растворе, образуя гидроксид натрия.
Взаимодействие металла с кислородом имеет различные практические применения. Например, алюминий окисляется на воздухе, образуя пленку оксида, которая защищает его от дальнейшего окисления. Это свойство делает алюминий надежным материалом для производства конструкций и упаковки. Кроме того, реакция металлов с кислородом широко используется в процессах получения металлических оксидов и других соединений, которые имеют промышленное значение.
Этапы реакции
1. Окисление металла: В начале реакции металл восстановитель окисляется, теряя электроны. Это происходит под влиянием кислорода, который является окислителем. Процесс окисления металла может протекать быстро или медленно в зависимости от его активности.
2. Выделение электронов: В результате окисления металла происходит выделение электронов, которые становятся доступными для других реакций. Электроны передаются на внешнюю оболочку атома металла и формируют отрицательные ионы металла.
3. Перенос электронов через электролит: Электроны, выделенные при окислении металла, передаются через электролит (обычно раствор или плавленная соль) к месту восстановления, где происходит восстановление окислителя.
4. Восстановление окислителя: В конечном этапе реакции окислитель (в данном случае кислород) восстанавливается, принимая электроны от металла восстановителя. Этот процесс может сопровождаться образованием соответствующих оксидов или кислородных ионов.
5. Образование продуктов реакции: В результате реакции между металлом и кислородом образуются продукты реакции, которые могут включать оксиды металла, гидроксиды или соли. В зависимости от условий реакции и свойств металла могут образовываться различные продукты реакции.
Реакция металла с кислородом может применяться в различных областях, таких как металлургия, химическая промышленность, энергетика и другие. Она используется для получения металлических оксидов для производства керамики и стекла, а также для получения энергии в процессе горения металлов в кислороде.
Применение в промышленности

Реакция металла восстановителя и кислорода широко применяется в различных отраслях промышленности.
Металлургия: В процессе выплавки стали и других металлов используется реакция восстановления для удаления примесей и получения чистого металла. Кислород и металлический восстановитель (например, углерод) взаимодействуют, приводя к образованию оксидов примесей, которые могут быть легко удалены.
Химическая промышленность: Реакция восстановления металла и кислорода используется для производства различных химических веществ. Например, в процессе синтеза органических соединений восстановитель может быть использован для добавления водорода в молекулу, а затем кислород может быть использован для окисления других атомов.
Электроэнергетика: В процессе генерации электроэнергии с помощью тепловых станций, реакция металла восстановителя и кислорода может играть важную роль. Например, угольный восстановитель с кислородом может быть использован для сжигания угля и производства пара, который затем приводит турбину в движение и генерирует электричество.
Таким образом, реакция металла восстановителя и кислорода имеет широкое применение в промышленности и играет важную роль в различных процессах, связанных с производством, химией и генерацией энергии.
Применение в научных исследованиях

Реакция металла восстановителя и кислорода нашла широкое применение в научных исследованиях различных областей. Один из основных способов использования этой реакции в науке - это проведение электрохимических экспериментов.
В электрохимических исследованиях реакция металла восстановителя и кислорода используется для изучения особенностей взаимодействия различных веществ и образования электролитов. Этот метод позволяет получить данные о скорости реакции, изменении концентрации вещества и других химических параметрах.
Также реакция металла восстановителя и кислорода активно применяется в области катализа. Катализаторы на основе металлов восстановителей и кислорода используются для ускорения химических реакций. Исследования в этой области направлены на поиск эффективных катализаторов, которые могут применяться в промышленности и в производстве различных химических продуктов.
Другим областью применения реакции металла восстановителя и кислорода является аналитическая химия. Этот метод используется для определения концентрации различных веществ в растворах. Он позволяет получить точные и надежные результаты, а также проводить анализ образцов различной сложности и состава.
Таким образом, реакция металла восстановителя и кислорода имеет широкое применение в научных исследованиях, позволяя изучать различные химические процессы, ускорять реакции с помощью катализаторов и проводить анализ веществ в разнообразных образцах.
Вопрос-ответ

Что такое реакция металла восстановителя и кислорода?
Реакция металла восстановителя и кислорода - это химическая реакция, в которой металл восстанавливает соединение кислорода в оксиде.
Какие основные этапы происходят при реакции металла восстановителя и кислорода?
Основные этапы реакции металла восстановителя и кислорода включают адсорбцию кислорода на поверхности металла, диффузию кислорода через поверхностный слой металла и реакцию кислорода с металлом.
Какие металлы являются восстановителями кислорода?
Некоторые примеры металлов, являющихся восстановителями кислорода, включают алюминий, магний, титан, натрий и калий.
В каких областях применяется реакция металла восстановителя и кислорода?
Реакция металла восстановителя и кислорода широко применяется в различных областях, включая металлургию, производство металлических сплавов, производство полупроводниковых материалов и окислителей в химической промышленности.
Какова роль кислорода в реакции с металлом восстановителем?
Кислород играет роль окислителя в реакции с металлом восстановителем. Он принимает электроны от металла, что приводит к образованию оксида металла.
