Металлы являются важной группой химических элементов, обладающих высокой электропроводностью и теплопроводностью. Один из наиболее интересных аспектов свойств металлов - их взаимодействие с другими веществами. Одним из таких веществ является хлороводород, соединение водорода и хлора, которое обладает выраженными кислотными свойствами.
Металлические ионы могут реагировать с хлороводородом, образуя соли металлов и выделяя газообразный водород. Данная реакция является типичной для большинства металлов, но скорость ее протекания и характер получаемых продуктов зависят от типа металла.
Некоторые металлы, такие как железо и алюминий, реагируют с хлороводородом достаточно интенсивно, образуя стабильные соли и освобождая значительные объемы водорода. Однако, есть и металлы, такие как золото и платина, которые практически не реагируют с хлороводородом, и их реакция проходит очень медленно или не происходит вообще.
Взаимодействие металлов с хлороводородом имеет большое значение в различных отраслях промышленности. Например, с использованием этой реакции можно получать нужные соли металлов для производства разнообразных продуктов, а также получать водород в процессе электролиза воды.
Особенностью взаимодействия металлов с хлороводородом является то, что реакция может протекать как при обычных условиях, так и при повышенных температурах. Некоторые металлы могут быть атакованы хлороводородом и при комнатной температуре, что делает их использование ограниченным в определенных сферах применения.
В целом, взаимодействие металлов с хлороводородом представляет большой научный и практический интерес, и изучение этого процесса позволяет лучше понять химические свойства металлов и разработать новые способы их использования.
Металл и хлороводород: взаимодействие и его особенности

Металлы и хлороводород обладают разными свойствами, что ведет к особым особенностям их взаимодействия. Хлороводород – это сильная кислота, состоящая из молекул водорода и хлора. Металлы, в свою очередь, являются элементами периодической таблицы, обладающими определенной реакционной активностью. Взаимодействие этих двух веществ может быть как химическим, так и физическим.
При физическом взаимодействии металла и хлороводорода обычно происходит образование газа водорода. Это происходит из-за разложения кислоты на ионы, которые реагируют с поверхностью металла, образуя с ним соединение. В результате такой реакции в металле образуются отверстия, называемые порами. Проходя через поры, хлороводород взаимодействует с металлом и образует соединение, которое накопливается на поверхности металла. Возникающие при этом химические реакции могут приводить к образованию новых соединений или изменению свойств металла.
Особенности химического взаимодействия металла и хлороводорода определяются их химическими свойствами. Металлы часто служат катализаторами химических реакций с участием хлороводорода. Катализаторы – это вещества, которые ускоряют химические реакции, но при этом не участвуют в их окончательном продукте. Взаимодействие металла и хлороводорода может привести к образованию хлоридов металлов, которые имеют различные свойства и широко используются в промышленности.
Абсорбция хлороводорода металлом
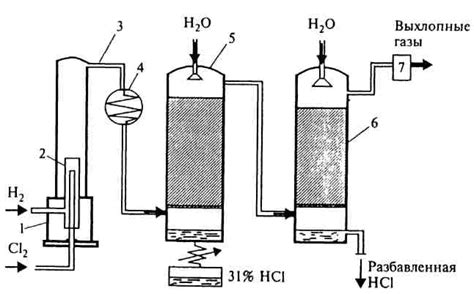
Хлороводород (HCl) – это один из самых распространенных химических реагентов, который активно взаимодействует с различными веществами. В частности, важную роль играет взаимодействие металлов с хлороводородом.
Многие металлы имеют способность абсорбировать хлороводород и образовывать с ним соли. Абсорбция – это процесс поглощения газов или паров веществами, обладающими достаточной поверхностью для взаимодействия. Взаимодействие металлов с хлороводородом осуществляется посредством химических реакций и может протекать на поверхности металла или внутри его кристаллической решетки.
При абсорбции хлороводорода металлами происходит образование солей металлов, содержащих ион хлорида (Cl-). Это особенно ярко проявляется при взаимодействии с щелочными и щелочноземельными металлами. Хлориды таких металлов обладают высокой растворимостью в воде и находят широкое применение в различных отраслях промышленности.
Абсорбция хлороводорода металлом может происходить в условиях различных реакций, например, при действии металла на хлороводородную кислоту. В результате этого взаимодействия происходит выброс водорода и образование растворимого в воде металлического хлорида. Также абсорбция хлороводорода может осуществляться при погружении металлического предмета в раствор хлороводородной кислоты.
Вопрос-ответ

Что такое хлороводород?
Хлороводород (HCl) - это химическое соединение из водорода и хлора. Оно является одним из самых распространенных хлоридных соединений и обладает резким запахом.
Как металлы взаимодействуют с хлороводородом?
Металлы могут вступать в реакцию с хлороводородом, образуя соединения металлического хлорида и выделяя водород. В зависимости от свойств металла и условий реакции, взаимодействие может быть более или менее интенсивным.
Каким образом металлы реагируют с хлороводородом?
Металлы реагируют с хлороводородом, образуя металлические хлориды и выделяя водородный газ. Это происходит в результате замещения водорода хлором в соединении. Например, реакция железа (Fe) с хлороводородом (HCl) приводит к образованию хлорида железа (FeCl2) и выделению молекул водорода (H2).
Какие факторы могут влиять на скорость реакции металла с хлороводородом?
Скорость реакции металла с хлороводородом может зависеть от различных факторов, включая тип используемого металла, концентрацию хлороводорода, температуру, поверхность металла и наличие катализаторов. Например, металлы с более активными свойствами, такие как натрий или калий, будут быстрее реагировать с хлороводородом, чем менее активные металлы, такие как железо или алюминий.
Для чего используется хлороводород?
Хлороводород широко используется в промышленности для производства хлорных соединений, таких как пластик, резина и хлорные растворители. Он также используется в лабораториях и в процессе очистки воды, а также в качестве кислотного растворителя.
