Металлы и ортофосфорная кислота – два важных химических компонента, которые играют значительную роль в различных областях науки и промышленности. Металлы являются основой многих материалов и используются в различных инженерных конструкциях, производстве электроэнергии и производстве множества товаров. Ортофосфорная кислота, или фосфорная кислота (H3PO4), является одной из важнейших кислот, применяемой в агрохимии, медицине и промышленности.
Свойства металлов, такие как электропроводность, теплоотводность и пластичность, являются основными причинами их широкого использования в различных отраслях промышленности. Однако, взаимодействие металлов с кислотами может приводить к различным химическим реакциям, которые важны для понимания и изучения химических процессов.
Металлы могут реагировать с ортофосфорной кислотой и образовывать соли и газы. Например, реакция алюминия с фосфорной кислотой приводит к образованию алюминийфосфата и выделению водорода. Этот процесс имеет практическое применение при производстве водорода и его соединений.
Одной из особенностей взаимодействия металлов с ортофосфорной кислотой является их коррозия. Реакция коррозии может изменить физические и химические свойства металла, что может привести к его деградации и повреждению материалов, содержащих металлические компоненты.
Таким образом, химические реакции металлов с ортофосфорной кислотой являются важными для понимания и изучения свойств и особенностей этих материалов. Изучение таких реакций позволяет разрабатывать новые материалы и технологии, а также улучшать качество существующих продуктов и процессов.
Металлы и ортофосфорная кислота: химические реакции и особенности

Ортофосфорная кислота (H3PO4) является одним из важных химических соединений, которое находит широкое применение в различных отраслях промышленности. Она образуется при сжигании фосфора на воздухе или при окислении фосфоритов. Кислота обладает высокой кислотностью и взаимодействует с различными металлами, образуя соли.
Металлы различно взаимодействуют с ортофосфорной кислотой. Например, щелочные металлы, такие как натрий (Na) и калий (K), реагируют с кислотой, образуя соли фосфорной кислоты (фосфаты). Это реакция нейтрализации, при которой выделяется энергия и образуется вода.
Некоторые металлы, такие как алюминий (Al), магний (Mg) и цинк (Zn), также реагируют с ортофосфорной кислотой, но в этом случае образуются соединения смешанной солевой структуры. Эти реакции происходят благодаря защитной сложносолевой пленке, которая образуется на поверхности металла и замедляет дальнейшее растворение.
Ортофосфорная кислота также реагирует с рядом других металлов, таких как железо (Fe), медь (Cu) и свинец (Pb), образуя фосфатные соединения. Эти соединения находят применение в различных отраслях, включая производство удобрений, пластмасс, красителей и стекла.
Важно отметить, что некоторые металлы, такие как ртуть (Hg) и серебро (Ag), не реагируют с ортофосфорной кислотой, поскольку они обладают низкой активностью и стабильностью.
Реакции металлов с ортофосфорной кислотой

Ортофосфорная кислота, также известная как фосфорная(V) кислота или H₃PO₄, является одной из самых распространенных кислот в химии. Она широко применяется в различных отраслях промышленности и науке, благодаря своим уникальным свойствам и реакционной способности.
Многие металлы могут реагировать с ортофосфорной кислотой, образуя соли фосфорной кислоты. Такие реакции происходят путем замещения водорода в кислоте на металл. Образовавшаяся соль может быть пропущена через фильтр, чтобы получить чистый продукт.
Реакции металлов с ортофосфорной кислотой могут происходить с выделением взрывоопасных газов, таких как фосфаны. Некоторые металлы, такие как натрий и калий, реагируют взрывоопасно с ортофосфорной кислотой, требуя особой осторожности при проведении таких реакций.
При взаимодействии металлов с ортофосфорной кислотой могут образовываться различные соли фосфорной кислоты, такие как фосфаты. Фосфаты имеют широкий спектр применений, включая использование в сельском хозяйстве в качестве удобрений, а также в производстве минеральных добавок и лекарств.
Химические свойства ортофосфорной кислоты

Ортофосфорная кислота (H3PO4) является одной из наиболее распространенных и важных кислот в химии. Ее химические свойства определяют широкое применение в различных отраслях промышленности и научных исследованиях.
Одной из особенностей ортофосфорной кислоты является то, что она является кислотой многозвенной структуры. Это означает, что она обладает тремя необязательными отрицательными зарядами, которые могут быть компенсированы положительными зарядами других элементов или ионов. Таким образом, она может образовывать соли, называемые фосфатами, с различными металлами.
Ортофосфорная кислота также обладает сильными окислительными свойствами. Она может реагировать с различными органическими и неорганическими соединениями, окисляя их и образуя новые продукты. Это делает ее полезным реагентом во многих химических процессах, включая производство удобрений, очистку воды и производство фармацевтических препаратов.
Ортофосфорная кислота также образует полимеры, которые обладают различными свойствами. Например, полифосфаты, полученные путем полимеризации ортофосфорной кислоты, могут быть использованы в качестве протектора от огня и добавок для улучшения текучести бетона.
Таким образом, ортофосфорная кислота обладает разнообразными химическими свойствами, которые позволяют ей широко применяться в различных отраслях промышленности и научных исследованиях. Ее уникальные особенности делают ее важным компонентом в производстве различных продуктов и материалов.
Металлы и образование соединений с ортофосфорной кислотой

Ортофосфорная кислота (H3PO4) - это одна из наиболее распространенных неорганических кислот, которая широко используется в различных отраслях промышленности. Металлы, в свою очередь, являются основой многих материалов и имеют разнообразные свойства и реакции.
При контакте металлов с ортофосфорной кислотой происходят химические реакции, в результате которых образуются соединения между металлами и фосфорной кислотой. Это связано с активностью и реакционной способностью металлов, а также их способностью образовывать ионы или комплексы при взаимодействии с различными соединениями.
В зависимости от химических свойств и реакционной способности металлов, образующиеся соединения могут иметь различное строение и свойства. Например, при реакции алюминия с ортофосфорной кислотой образуется алюминийфосфат (AlPO4), который обладает высокой термической стабильностью и применяется в качестве добавки в огнеупорных материалах.
Металлы могут образовывать с ортофосфорной кислотой различные соединения, такие как фосфаты, фосфиды и комплексы. Химические реакции между металлами и ортофосфорной кислотой важны для понимания и применения металлических материалов в различных сферах деятельности, включая химическую промышленность, электроэнергетику, металлургию и другие.
Физические свойства соединений металлов с ортофосфорной кислотой
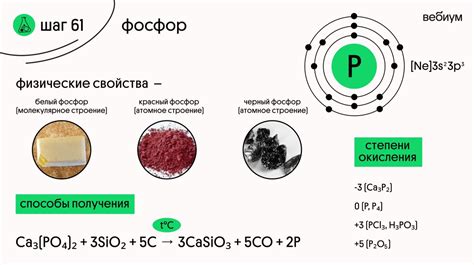
Ортофосфорная кислота является трехосновной кислотой, химическая формула которой H3PO4. Это бесцветная кристаллическая вещество, хорошо растворимое в воде. Ортофосфорная кислота обладает высокой кислотностью и сильно коррозивна, поэтому при работе с ней необходимо соблюдать особую осторожность.
Металлы имеют различные физические свойства, и их соединения с ортофосфорной кислотой также обладают своими особенностями. Например, металлы, такие как железо (Fe), магний (Mg) и цинк (Zn), реагируют с ортофосфорной кислотой, образуя фосфаты этих металлов. Фосфаты металлов обычно являются белыми кристаллическими веществами.
Соединения металлов с ортофосфорной кислотой обладают различной растворимостью в воде. Например, фосфат магния (Mg3(PO4)2) нерастворим в воде, в то время как фосфат железа (III) (FePO4) растворим. Растворимость соединений металлов с ортофосфорной кислотой может зависеть от pH среды, температуры и концентрации реагентов.
Эти соединения металлов с ортофосфорной кислотой обладают различными физическими свойствами, такими как плотность, температура плавления и кипения. Например, фосфат магния является твердым веществом с плотностью 2,22 г/см3 и температурой плавления около 1180 градусов Цельсия. Фосфат железа (III) имеет плотность около 3,87 г/см3 и температуру плавления около 1550 градусов Цельсия.
Физические свойства соединений металлов с ортофосфорной кислотой могут иметь важное значение при их применении в различных областях, таких как металлургия, химическая промышленность и сельское хозяйство.
Использование металлов и ортофосфорной кислоты в промышленности

Металлы и ортофосфорная кислота широко применяются в промышленности благодаря своим уникальным химическим свойствам. Металлы являются основой многих промышленных процессов и используются в различных отраслях, включая металлургию, строительство, энергетику и электронику.
Ортофосфорная кислота, также известная как фосфорная кислота, является важным реагентом в производстве химических веществ. Она используется в процессе синтеза органических соединений, в производстве удобрений, а также в производстве пищевых добавок и фармацевтических препаратов.
В металлургии металлы используются в процессе обработки и получения различных сплавов. Например, железо является основным компонентом стали - одного из самых популярных строительных материалов. Алюминий применяется в авиационной и автомобильной промышленности благодаря своим легким и прочным свойствам.
В электронной промышленности металлы применяются в процессе создания электронных компонентов, таких как провода, платы и чипы. Золото и серебро используются в производстве контактных покрытий для обеспечения надежного электрического соединения.
Ортофосфорная кислота находит применение в процессе производства удобрений, так как является источником фосфора - одного из основных питательных веществ для растений. Кроме того, она используется в качестве реагента в синтезе органических соединений, включая фармацевтические препараты и пищевые добавки.
В целом, использование металлов и ортофосфорной кислоты в промышленности является неотъемлемой частью многих производственных процессов и играет важную роль в различных отраслях экономики.
Вопрос-ответ

Какие металлы реагируют с ортофосфорной кислотой?
Ортофосфорная кислота (H3PO4) реагирует с различными металлами, включая алюминий, железо, цинк, магний и некоторые другие. Реакция металла с ортофосфорной кислотой приводит к образованию соответствующего фосфатного соединения и выделению водорода.
Какая химическая реакция происходит при контакте ортофосфорной кислоты с алюминием?
При контакте ортофосфорной кислоты с алюминием происходит реакция, в результате которой образуется алюминийфосфат (AlPO4) и выделяется водородный газ.
Что происходит при взаимодействии железа с ортофосфорной кислотой?
При взаимодействии железа с ортофосфорной кислотой образуется железофосфат (FePO4) и выделяется водород.
Может ли магний вступать в реакцию с ортофосфорной кислотой?
Да, магний способен реагировать с ортофосфорной кислотой. При реакции образуется магниевый фосфат (Mg3(PO4)2) и выделяется водород.
Какие особенности химических реакций металлов с ортофосфорной кислотой можно выделить?
Основной особенностью реакции металлов с ортофосфорной кислотой является образование фосфатных соединений и выделение водорода. Реакция протекает с выделением тепла. Кроме того, скорость реакции может зависеть от концентрации и температуры реагентов.
