Реакция растворов кислот с металлами является одним из основных процессов в химии. Кислоты - это химические соединения, обладающие кислотными свойствами, а металлы - это элементы периодической системы, характеризующиеся металлической прочностью и проводимостью электричества.
Одной из особенностей реакции растворов кислот с металлами является выделение газа в результате химической реакции. Например, раствор соляной кислоты взаимодействует с металлом цинком, при этом выделяется водородный газ. Это свойство можно наблюдать при проведении определенных химических экспериментов.
Еще одной особенностью реакции растворов кислот с металлами является образование соответствующих солей. При взаимодействии кислоты с металлом образуется хлорид цинка, а вода и молекулы кислоты участвуют в реакции, образуя ионы водорода. Подобные процессы могут происходить с различными кислотами и металлами, что делает этот тип реакций очень важным в химии и научных исследованиях.
Реакция растворов кислот с металлами также зависит от концентрации кислоты и металлического элемента. Чем больше концентрация кислоты, тем быстрее происходит реакция, а чем больше металла, тем более интенсивное образование газа. Это является важным фактором при проведении химических опытов и возможностях применения данных реакций в промышленном производстве.
В целом, реакция растворов кислот с металлами является интересным и важным объектом изучения в области химии. Эти реакции применяются не только в научных исследованиях, но и в промышленности, где они играют важную роль в процессе получения и обработки различных веществ. Понимание особенностей и свойств данной реакции позволяет создавать новые материалы и технологии, что является важным вкладом в развитие современной науки и промышленности.
Воздействие кислот на металлы: основные аспекты
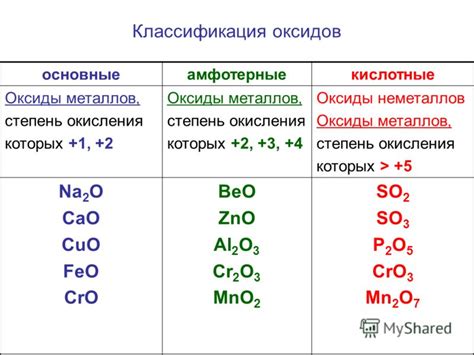
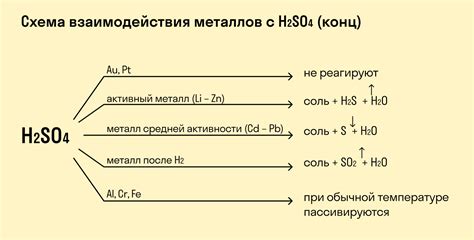
Реакция растворов кислот с металлами является одной из основных и хорошо изученных химических реакций. В ходе этой реакции происходит образование солей и выделение водорода. Взаимодействие кислот с металлами зависит от различных факторов, таких как вид кислоты и металла, их концентрация, температура и т.д.
Одним из главных факторов, влияющих на реакцию кислоты с металлом, является активность металла. В качестве активных металлов можно назвать натрий, калий, литий и другие, которые быстро взаимодействуют с кислотой, выделяя большое количество водорода. Неактивные металлы, такие как железо, медь или свинец, реакцию с кислотой не проявляют или проявляют ее очень слабо.
Для реакции между кислотой и металлом также важна концентрация кислоты. При низкой концентрации кислоты скорость реакции будет меньше, а при высокой концентрации - больше. Также температура влияет на восприимчивость металла к кислотным реакциям – при повышенной температуре металл может быстрее растворяться в кислоте и образовывать соли.
Степень растворимости металла в кислоте также может зависеть от свойств самой кислоты. Например, серная кислота, соляная кислота и азотная кислота обладают сильными кислотными свойствами и могут быстро и интенсивно реагировать с металлами. В то же время, уксусная кислота или фосфорная кислота реагируют медленнее и менее активно.
Изучение реакции кислот с металлами является важным звеном различных химических процессов и находит свое применение в различных областях науки и промышленности.
Химические реакции между кислотами и металлами
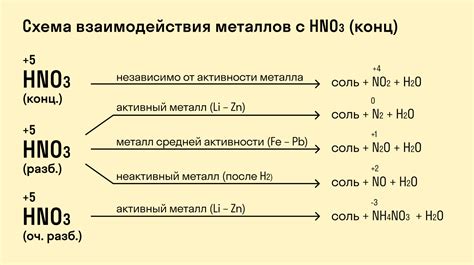
Реакции кислот с металлами являются одними из основных химических реакций, которые происходят в нашей повседневной жизни. В результате этих реакций образуются соли и выделяется водород. Реакции кислот с металлами хорошо изучены и имеют большое практическое значение.
Кислоты - это вещества, обладающие кислотными свойствами, они могут отдавать протоны. Чаще всего в качестве кислот используются растворы неорганических кислот, таких как серная, хлороводородная или азотная кислоты. Металлы - это химические элементы, обладающие металлическими свойствами, т.е. хорошо проводящие тепло и электричество.
Реакция кислот с металлами происходит следующим образом: кислота отдает свой протон металлу, образуя соль, а металл отдает свои электроны кислороду кислоты, образуя ион водорода. В результате реакции выделяется газ водород и образуется соль металла и кислота-остаток.
Такие реакции могут протекать лишь с определенными металлами, так как не все металлы способны образовывать соли с кислородом. Кроме того, некоторые металлы способны вступать в реакцию только с определенными кислотами. Например, цинк быстро реагирует с соляной кислотой, образуя хлорид цинка и выделяя водородный газ, алюминий может вступать в реакцию только с сильными кислотами, такими как серная или нитрированная кислоты.
Реакции кислот с металлами имеют широкое применение в различных областях. Например, в химической промышленности для получения солей, в бытовой химии для очистки поверхностей от загрязнений, а также в процессах выделения водорода или очистки газов.
Уравнения реакций между кислотами и металлами могут быть представлены следующим образом:
- Серная кислота + цинк = сульфат цинка + водород;
- Хлороводородная кислота + алюминий = хлорид алюминия + водород;
- Нитрированная кислота + железо = нитрат железа + водород.
Таким образом, реакции кислот с металлами являются важным объектом изучения в химии и имеют многочисленные практические применения.
Свойства и изменения металлов при взаимодействии с кислотами
Взаимодействие металлов с кислотами является важной химической реакцией, которая приводит к образованию солей и выделению водорода. При контакте с кислотами металлы проявляют различные свойства и изменения.
Во-первых, металлы, обладающие активными свойствами, реагируют с кислотами достаточно интенсивно. Они способны активно вступать в химические реакции, образуя соли и выделяя водород. Например, натрий при взаимодействии с соляной кислотой образует хлорид натрия и выделяет молекулярный водород.
Во-вторых, при взаимодействии с кислотами некоторые металлы могут претерпевать окислительно-восстановительные реакции. Например, медь при контакте с разбавленной серной кислотой окисляется до двухвалентного ионного состояния, а серная кислота восстанавливается до сернистой кислоты.
В-третьих, некоторые металлы способны образовывать защитные пленки из основных солей, которые предотвращают дальнейшее взаимодействие с кислотой. Например, алюминий при контакте с соляной кислотой образует пленку из хлорида алюминия, которая предотвращает дальнейшее растворение металла.
В-четвертых, некоторые металлы, такие как золото и платина, не реагируют с кислотами, так как они являются химически стабильными. Они обладают высокой устойчивостью к коррозии и практически не проявляют активности при контакте с кислотами.
Таким образом, реакция металлов с кислотами обусловлена их химическими свойствами и может приводить к различным изменениям состояния металла, образованию солей и выделению водорода.
Особенности растворения металлов в кислотах
Растворение металлов в кислотах является важным процессом, представляющим интерес для изучения. Оно осуществляется путем химической реакции, в результате которой образуется соль и выделяется водород. В основе этого процесса лежит взаимодействие ионов металла с ионами кислоты.
Одной из основных особенностей растворения металлов в кислотах является их электрохимическая активность. Некоторые металлы, такие как цинк и алюминий, растворяются в кислотах с высокой активностью и интенсивно реагируют. Другие металлы, такие как золото и платина, являются менее активными и реагируют с кислотами значительно медленнее.
Растворение металлов в кислотах также зависит от концентрации кислоты и температуры раствора. Высокая концентрация кислоты и повышенная температура обеспечивают более интенсивное растворение металла. Важно отметить, что контролировать скорость реакции можно с помощью добавления ингибиторов или катализаторов.
Другим аспектом растворения металлов в кислотах является возможность образования побочных продуктов реакции. Например, растворение железа в различных кислотах может привести к образованию различных соединений и ионов железа. При этом, в зависимости от конкретных условий реакции, продукты реакции могут быть как растворимыми, так и нерастворимыми.
Таким образом, растворение металлов в кислотах характеризуется электрохимической активностью металла, зависит от концентрации кислоты и температуры, а также может быть сопровождаться образованием различных продуктов реакции. Изучение этих особенностей важно для понимания химических процессов и разработки новых материалов и технологий.
Опасности и меры предосторожности при реакциях кислот с металлами
Реакции кислот с металлами могут быть крайне опасными, поэтому необходимо соблюдать определенные меры предосторожности для обеспечения безопасности.
Во-первых, необходимо надеть специальные защитные средства перед началом работы. В зависимости от конкретной кислоты и металла, это могут быть защитные очки, резиновые перчатки, халат и даже респиратор.
Во-вторых, необходимо тщательно выбирать металлы для проведения экспериментов. Некоторые металлы, такие как натрий и калий, могут вызывать взрывы или пожар при реакции с кислотами. Поэтому не рекомендуется использовать их в таких экспериментах.
Для проведения реакций кислот с металлами необходимо находиться в хорошо проветриваемом помещении или проводить эксперименты под вытяжкой. Это необходимо, чтобы избежать вдыхания токсичных газов, которые могут образовываться в результате реакций.
Также следует помнить, что при проведении реакций образуется значительное количество тепла. Поэтому необходимо быть внимательными и аккуратными, чтобы избежать обжигов или возгорания.
В случае контакта с кислотой или продуктами реакции, необходимо немедленно промыть зону контакта большим количеством воды. Если возникают серьезные симптомы или ощущения неудобства, необходимо обратиться за медицинской помощью.
Сферы применения реакции металлов с кислотами
Реакция металлов с кислотами широко используется в различных сферах нашей жизни. Например, она находит применение в промышленности для получения различных металлореактивов, необходимых для дальнейшего использования в производстве химических соединений. Также эта реакция активно применяется в лабораторных условиях, где она является основой многих химических экспериментов и анализов.
В медицине реакция металлов с кислотами применяется для получения металлических солей, которые играют важную роль в лечении определенных заболеваний. Например, медицинские препараты, содержащие железо, используются для компенсации его недостатка в организме. Кроме того, реакция металлов с кислотами используется в производстве батареек и аккумуляторов, где металлические элементы являются активными участниками электрохимических процессов.
Также, реакция металлов с кислотами может находить применение в различных сферах быта. Например, она используется для очистки поверхностей от накипи и ржавчины. Кислотные растворы, образующиеся в результате этой реакции, активно взаимодействуют с загрязнениями и помогают эффективно удалять их с поверхностей. Кроме того, реакция металлов с кислотами может быть использована для очистки воды от различных примесей.
Практические примеры и эксперименты с взаимодействием кислот и металлов

Взаимодействие кислот с металлами является широко изученной областью химии. Эти реакции могут использоваться как в учебных целях, так и в промышленности. Рассмотрим несколько практических примеров и экспериментов с взаимодействием кислот и металлов.
1. Реакция соляной кислоты с железом:
- При добавлении соляной кислоты к обычным гвоздям происходит побурение вещества и выделение пузырьков газа.
- Эксперимент можно выполнить, положив несколько гвоздей в пробирку с соляной кислотой и наблюдая образование газа и изменение цвета раствора.
2. Реакция серной кислоты с медью:
- При взаимодействии серной кислоты с медью происходит образование синего раствора с медным сульфатом и выделение газа диоксида серы.
- Эксперимент можно провести, поместив медную проволоку в колбу с серной кислотой и наблюдая образование синего раствора и появление газа.
3. Реакция азотной кислоты с алюминием:
- При смешивании азотной кислоты с алюминием происходит интенсивное выделение газа и образование взрыва.
- Эксперимент можно провести, добавив немного кусочков алюминия в пробирку с азотной кислотой и наблюдая реакцию.
Эти примеры и эксперименты помогают наглядно продемонстрировать химические свойства кислот и металлов. Они позволяют ученикам и студентам лучше понять принципы реакции между этими веществами и изучить их влияние друг на друга. Также практические эксперименты с взаимодействием кислот и металлов широко используются в промышленности для получения нужных продуктов и материалов.
Вопрос-ответ

Какие металлы могут реагировать с кислотами?
Металлы, наиболее активные реагенты среди всех элементов, их степень активности устанавливается в соответствии с так называемым "рядом активности металлов". В реакции с кислотами различают три группы металлов: активные, уравновешенные и пассивные. К активным металлам относятся литий, натрий, калий, варенье и цезий, а также алюминий, магний, цинк и железо. Уравновешенные металлы включают свинец, медь и марганец. Пассивными считаются никель, хром, магний и алюминий.
Что происходит при реакции кислоты с активными металлами?
При реакции кислоты с активными металлами происходит образование соли и выделение водорода. Например, реакция кислоты с цинком протекает следующим образом: Zn + 2HCl → ZnCl2 + H2.
Что происходит при реакции кислоты с уравновешенными металлами?
При реакции кислоты с уравновешенными металлами также образуется соль и выделяется водород, но сама реакция проходит медленнее и менее интенсивно. Например, реакция кислоты с медью может протекать следующим образом: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
Как организовать эксперимент по реакции кислоты с металлом?
Для проведения эксперимента по реакции кислоты с металлом необходимо взять небольшое количество выбранного металла и разместить его в пробирке или другой стеклянной емкости. Затем на металл следует добавить небольшое количество кислоты и наблюдать за изменениями, которые происходят. Важно помнить о безопасности при проведении такого эксперимента и работать с кислотой и металлом в перчатках и защитных очках.
