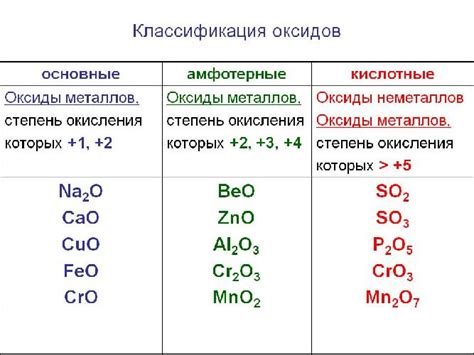
Оксиды - это вещества, состоящие из кислорода и других элементов, в основном металлов. Они играют важную роль в химических реакциях, в том числе и взаимодействием с кислотными оксидами. В данной статье мы рассмотрим процесс реакции кислотного оксида с оксидом металла, особенности этого взаимодействия и предоставим несколько примеров конкретных реакций.
Кислотные оксиды представляют собой соединения, в которых преобладает кислород. Они реагируют с оксидами металлов, образуя соли и воду. Кислотные оксиды могут быть получены путем окисления соответствующих веществ, например, окислением кислородом воздуха.
Важной особенностью реакции кислотного оксида с оксидом металла является то, что она протекает с образованием солей. Соли образуются путем замены атомов оксида металла на атомы кислотного оксида. В результате происходит взаимодействие ионов, образующихся в процессе реакции.
Примером реакции кислотного оксида с оксидом металла является взаимодействие двуокиси серы (SO2) с оксидом кальция (CaO). При этом образуется сульфат кальция (CaSO4) и вода (H2O):
SO2 + CaO → CaSO4 + H2O
Эта реакция является одним из способов получения сульфата кальция - вещества, которое широко используется в строительстве, производстве цемента и в других отраслях промышленности.
Что такое реакция кислотного оксида с оксидом металла?
Реакция кислотного оксида с оксидом металла — это химический процесс, при котором кислотный оксид реагирует с оксидом металла, образуя соль и воду. Кислотные оксиды обладают свойством растворяться в воде и образовывать кислоты, а оксиды металлов могут образовывать основания. Поэтому при их взаимодействии происходит нейтрализационная реакция, образуется соль — соединение, в котором кислотный остаток вступает в сочетание с металлическим катионом.
Примером такой реакции может служить взаимодействие диоксида серы (SO2) с оксидом кальция (CaO), при котором образуется сульфат кальция (CaSO4) и вода. Уравнение реакции будет выглядеть следующим образом: SO2 + CaO → CaSO4 + H2O.
Важно отметить, что в результате реакции кислотного оксида с оксидом металла образуется соль, которая может быть как растворимой, так и нерастворимой в воде. Причем реакция может протекать при разных условиях, например, при нагревании или взаимодействии с водой. Также стоит учитывать, что соль, образовавшаяся в результате данной реакции, может проявлять свойства как кислоты, так и основания.
Основные особенности реакции

Реакция между кислотным оксидом и оксидом металла – это один из типов химических превращений, которое происходит при взаимодействии кислотного оксида с оксидом металла. Эта реакция имеет свои особенности, которые важно учитывать при исследовании и описании химических процессов.
Во-первых, при реакции кислотного оксида с оксидом металла образуется соль и вода. Кислотный оксид содержит в своей структуре кислород и не металлические элементы, а оксид металла – кислород и металл. Их реакция приводит к образованию соли, которая состоит из ионов металла и кислородных ионов из кислотного оксида.
Во-вторых, данная реакция может протекать как в водных растворах, так и в твердом состоянии. В водных растворах реакцию можно наблюдать непосредственно, появляется новое вещество – соль, которая растворяется в воде. В твердом состоянии образующаяся соль может образовывать кристаллическую решетку или же образовывать солевой осадок.
В-третьих, в результате данной реакции может выделяться или поглощаться тепло. Если реакция сопровождается выделением тепла, это означает, что реакция идет с выделением энергии. Если реакция поглощает тепло, то она является эндотермической и идет с поглощением энергии.
Механизм реакции

Реакция кислотного оксида с оксидом металла основана на взаимодействии кислорода, содержащегося в составе обоих веществ. При этом происходит образование соли и воды или кислоты и основания.
Кислотный оксид реагирует с оксидом металла по следующей схеме: кислотный оксид + основной оксид = соль + вода. В данном случае кислотный оксид действует как кислота, а основной оксид - как основание.
Механизм такой реакции заключается в том, что молекулы кислотного оксида передают свои протоны (H+) молекулам основного оксида. Происходит образование воды, а также соответствующей соли.
Например, при реакции кислородного оксида с оксидом кальция, образуется гидроксид кальция и вода:
- CaO + CO2 = CaCO3;
- CaO + SO3 = CaSO4;
- CaO + P2O5 = Ca3(PO4)2.
Таким образом, механизм реакции кислотного оксида с оксидом металла состоит в том, что кислотный оксид действует как кислота и отдает протоны основному оксиду. В результате образуется соль и вода или кислота и основание.
Примеры реакций

Одной из наиболее известных реакций между кислотным оксидом и оксидом металла является реакция сульфида серы и оксида меди. При взаимодействии сульфида серы (S2-) с оксидом меди (CuO) образуется сульфид меди (CuS) и кислород:
2CuO + S2- → CuS + O2-
Другой пример реакции такого типа — реакция диоксида углерода и оксида цинка. При взаимодействии диоксида углерода (CO2) с оксидом цинка (ZnO) образуется углерод и оксид цинка:
ZnO + CO2 → Zn + CO2-
Еще один пример реакции кислотного оксида с оксидом металла — реакция диоксида серы и оксида железа. При взаимодействии диоксида серы (SO2) с оксидом железа (Fe2O3) образуется сульфид железа (FeS) и кислород:
3Fe2O3 + SO2 → 2FeS + 3O2-
Эти примеры показывают, что реакция кислотного оксида с оксидом металла приводит к образованию новых соединений и выделению кислорода.
Роль катализаторов в реакции
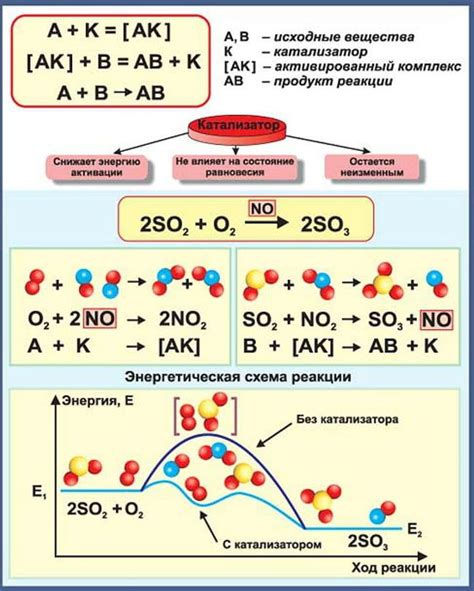
Катализаторы играют важную роль в химических реакциях, в том числе и в реакции между кислотными оксидами и оксидами металлов. Они повышают скорость реакции, ускоряя процесс образования новых веществ и увеличивая количество получаемого продукта.
Катализаторы могут оказывать влияние на реакцию, как на стороне оксида металла, так и на стороне кислотного оксида. На стороне оксида металла они могут обеспечить активацию слабых связей и участвовать в образовании промежуточных продуктов реакции. На стороне кислотного оксида они могут предоставить дополнительные активные центры для взаимодействия с металлом и участвовать в разрыве связей.
Катализаторы различаются по своей природе: они могут быть металлическими, кислотными или щелочными. В реакции между кислотными оксидами и оксидами металлов обычно используются металлические катализаторы, такие как платина, никель, медь и другие. Они обладают высокой активностью и эффективностью при проведении реакции.
Примером реакции, в которой используется катализатор, является реакция между диоксидом серы(SO2) и оксидом железа(III)(Fe2O3). При обычных условиях эта реакция может протекать очень медленно, но при наличии катализатора, такого как платина(Pt), скорость реакции значительно возрастает. Катализатор повышает активность обоих оксидов, стимулирует взаимодействие между ними и способствует более быстрому образованию новых веществ.
Каково значение реакции для промышленности?

Реакция кислотного оксида с оксидом металла является важной процессом для промышленности, так как она позволяет получать различные продукты, необходимые для производства различных материалов и веществ. Одним из наиболее значимых примеров такой реакции является реакция диоксида серы с оксидом железа, которая используется для производства серной кислоты.
Серная кислота является одним из ключевых химических веществ, используемых в промышленности. Она применяется в производстве удобрений, пластмасс, текстиля, бумаги и других важных продуктов. Реакция диоксида серы с оксидом железа является основным способом получения этой ценной кислоты.
Кроме того, реакция кислотного оксида с оксидом металла может использоваться для получения других ценных продуктов. Например, реакция оксида азота с оксидом алюминия может быть использована для получения серной кислоты. Этот метод является одним из основных способов получения данного продукта в промышленности.
Таким образом, реакция кислотного оксида с оксидом металла имеет большое значение для промышленности, поскольку она позволяет получать различные полезные продукты, необходимые для производства широкого спектра материалов и веществ. Она является ключевым этапом в производстве некоторых важных химических веществ и играет важную роль в различных отраслях промышленности.
Практическое применение реакции

Реакция кислотного оксида с оксидом металла является основой для множества практических применений. Эта реакция позволяет получать различные соединения, которые находят широкое применение в различных отраслях промышленности и научных исследованиях.
Одним из примеров практического применения реакции является получение кислорода. Для этого используется реакция кислорода с оксидами металлов, таких как оксид цинка или оксид меди. Кислород, полученный путем этой реакции, применяется в сжиженном или газообразном виде в медицине, промышленности и воздухоплавании.
Кроме того, реакция кислотного оксида с оксидом металла может быть использована для получения сложных соединений. Например, путем реакции оксида серы с оксидом ванадия получают сульфокислородистый ванадий – важный катализатор в химической промышленности. Также, реакции оксида азота с оксидом кобальта позволяют получать нитрозилкобальтаты, которые используются в аналитической химии для определения питательных веществ.
Другим практическим применением реакции является получение энергии. Одним из примеров может быть использование реакции оксида углерода с оксидом железа для получения тепла и энергии в промышленных печах и котлах. Также, реакция оксида калия с оксидом серы может быть использована для получения тепла и электроэнергии в ядерных реакторах.
Таким образом, реакция кислотного оксида с оксидом металла имеет широкое практическое применение в различных сферах деятельности - от получения кислорода и сложных соединений до производства энергии.
Вопрос-ответ

Какие особенности имеет реакция кислотного оксида с оксидом металла?
Реакция кислотного оксида с оксидом металла может протекать по разным механизмам в зависимости от условий и типов веществ, но обычно она происходит с образованием соли и воды. В такой реакции кислотный оксид действует как кислота, а оксид металла - как основание. Такая реакция характерна для большинства оксидов металлов и основных оксидов.
