Реакция кислот с оксидами металлов является одним из важных процессов в химии. Она позволяет получать новые соединения, обладающие различными свойствами и применением. Кислоты могут реагировать с оксидами металлов как в водном растворе, так и в газовой фазе, что открывает широкие возможности для исследования данного процесса.
Одной из особенностей реакции кислот с оксидами металлов является образование солей. При этом, происходит обмен протонов между кислотой и оксидом, что приводит к образованию гидроксидов металлов и воды. Механизм данной реакции зависит от активности кислоты и оксида металла, а также от условий проведения эксперимента.
Примером реакции кислоты с оксидом металла может быть реакция серной кислоты (H2SO4) с оксидом железа (Fe2O3). При этом образуется соль железа (III) серной кислоты - сульфат железа (III) (Fe2(SO4)3), а также образуется вода.
Данная реакция широко используется в промышленности, например, для получения железосерной руды, которая служит источником сырья для производства различных сплавов и материалов.
Таким образом, реакция кислот с оксидами металлов является важным процессом, позволяющим получать новые соединения с различными свойствами и применением. Она основана на обмене протонов между кислотой и оксидом, что приводит к образованию солей и воды. Результаты данной реакции имеют широкое применение в различных отраслях промышленности и науки.
Влияние кислот на оксиды металлов

Взаимодействие кислот с оксидами металлов представляет собой одну из фундаментальных реакций в химии. В зависимости от реактивности оксидов металлов и свойств кислот, реакция может протекать различными путями и иметь различные результаты.
Кислоты могут проявлять свою активность при контакте с оксидами металлов, образуя глубокую химическую реакцию. В результате такого взаимодействия с образованием солей и воды оксиды металлов испытывают изменения в структуре и свойствах.
Некоторые оксиды металлов реагируют с кислотами быстро и энергично, выделяя тепло и образуя пенообразные смеси. Другие оксиды металлов могут быть менее активными и требовать нагревания или добавления катализаторов для прохождения реакции.
Взаимодействие кислот с оксидами металлов может происходить через различные механизмы. Например, реакция может быть прокаталитической, когда кислоты и оксиды металлов взаимодействуют с образованием промежуточных соединений, которые затем подвергаются дальнейшим превращениям.
Примеры реакций кислот с оксидами металлов включают образование солей, таких как хлориды, сульфаты, нитраты и т. д. В результате этих реакций могут образовываться разнообразные продукты, которые имеют важное применение в различных областях науки и промышленности.
Особенности взаимодействия кислот с оксидами металлов

Взаимодействие кислот с оксидами металлов – это один из важных процессов в химии. В результате таких реакций образуется соль и вода. Особенностью этого типа реакций является способность металлических оксидов реагировать с кислотами при образовании солей с различными степенями окисления.
Механизм взаимодействия кислот с оксидами металлов основывается на обмене протонов между кислотой и оксидом. Кислота отдаёт протон, а оксид принимает его. В результате образуется соль и вода. Некоторые металлические оксиды могут быть амфотерными и реагировать как с кислотами, так и с щелочами.
Примеры взаимодействия кислот с оксидами металлов включают реакцию меди(II) оксида с серной кислотой, которая приводит к образованию соли меди(II)сульфата и воды. Ещё одним примером является реакция алюминия оксида с хлороводородной кислотой, при которой образуется соль алюминия хлорида и вода.
Взаимодействие кислот с оксидами металлов имеет широкое применение в разных областях, включая промышленность, медицину и научное исследование. Понимание особенностей этого типа реакций позволяет улучшить синтез новых соединений, разрабатывать эффективные методы очистки и получения металлов, а также предсказывать и контролировать реакции в разных средах.
Механизм реакции кислот с оксидами металлов
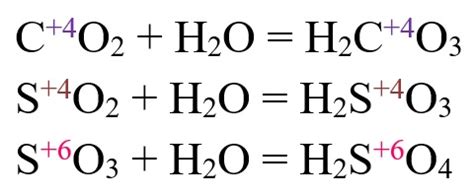
Реакции кислот с оксидами металлов происходят благодаря образованию новых химических связей между атомами и ионами. Механизм таких реакций состоит из нескольких этапов.
На первом этапе кислота, содержащая водород, реагирует с оксидом металла, выделяя молекулярный водород. Такая реакция называется реакцией обмена или диспропорционированием.
На втором этапе образовавшийся оксид взаимодействует с оставшейся кислотой, образуя соль и воду. Эта реакция является обычной кислотно-основной реакцией.
В результате проведения реакции кислоты с оксидом металла образуется соль, содержащая ионы металла, а также вода. Для каждой кислоты механизм реакции может быть различным в зависимости от ее свойств и активности металла, который присутствует в оксиде.
Примером реакции кислоты с оксидом металла может служить реакция серной кислоты с оксидом меди (II):
- Серная кислота (H2SO4) + Оксид меди (II) (CuO) → Сульфат меди (II) (CuSO4) + Вода (H2O)
Механизм реакции в данном случае включает образование водорода на первом этапе и образование сульфата меди (II) на втором этапе.
Примеры реакций кислот с оксидами металлов

Реакции кислот с оксидами металлов являются одним из важных классов химических реакций. Они протекают по типу обмена, при этом оксид металла действует как основание, а кислота - как кислотное соединение.
Например, реакция между серной кислотой (H2SO4) и оксидом меди (II) (CuO) приводит к образованию сульфата меди (II) (CuSO4):
CuO + H2SO4 → CuSO4 + H2O
Аналогично, реакция между соляной кислотой (HCl) и оксидом алюминия (Al2O3) приводит к образованию хлорида алюминия (AlCl3):
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
Кроме того, реакция между азотной кислотой (HNO3) и оксидом железа (III) (Fe2O3) приводит к образованию нитрата железа (III) (Fe(NO3)3):
Fe2O3 + 6 HNO3 → 2 Fe(NO3)3 + 3 H2O
Также можно привести в пример реакцию между уксусной кислотой (CH3COOH) и оксидом натрия (Na2O). В результате образуется ацетат натрия (CH3COONa) и вода:
Na2O + 2 CH3COOH → 2 CH3COONa + H2O
Таким образом, реакции кислот с оксидами металлов играют важную роль в химических процессах и имеют множество практических применений.
Реакция соляной кислоты с оксидом железа

Соляная кислота реагирует с оксидом железа в результате химической реакции, которая является примером реакции кислоты с оксидом металла. Оксид железа может быть представлен различными соединениями, включающими FeO, Fe2O3 или Fe3O4.
Химическое уравнение реакции между соляной кислотой и оксидом железа может быть представлено следующим образом:
FeO + 2HCl → FeCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Fe3O4 + 8HCl → 3FeCl2 + 4H2O
В ходе реакции кислоты с оксидом железа образуются соответствующие соли и вода. Также отмечается выделение газа – водорода.
Механизм реакции заключается в процессе образования ионов железа Fe2+ или Fe3+ из оксида железа и протонов H+ из соляной кислоты. В результате образуются хлориды железа FeCl2 или FeCl3 в зависимости от соотношения стехиометрических коэффициентов. Газ H2 выделяется в результате окислительного действия кислоты на железо и процесса выравнивания зарядов в реакции.
Реакция серной кислоты с оксидом меди

Реакция серной кислоты с оксидом меди является типичным примером реакции между кислотой и основанием, протекающей с образованием соли и воды. Серная кислота является одной из самых распространенных кислот, а оксид меди — одним из основных оксидов меди.
Механизм реакции можно описать следующим образом: серная кислота вступает во взаимодействие с оксидом меди, при этом ион водорода из кислоты замещается ионом меди, образуя соль — сернокислую медь, и выделяется молекула воды. Уравнение реакции выглядит следующим образом:
- H2SO4 + CuO → CuSO4 + H2O
При этой реакции образуется кристаллический порошок сернокислой меди, который обладает синей окраской. Сернокислая медь имеет широкое применение в различных отраслях, включая электротехнику, фотографию, лабораторную практику и др.
Реакция серной кислоты с оксидом меди является реакцией обмена, в результате которой изменяются химические связи между атомами и ионами. Она относится к классу реакций кислот с основаниями и имеет широкое практическое значение.
Реакция азотной кислоты с оксидом свинца

Реакция азотной кислоты с оксидом свинца представляет собой окислительно-восстановительную реакцию. Азотная кислота (HNO3) действует в данной реакции как окислитель, а оксид свинца (PbO) - как восстановитель.
В результате реакции, которая протекает при нагревании, образуется сульфат свинца (PbSO4) и оксид азота(IV) (NO2) или диоксид азота (NO2) в газообразной форме:
3PbO + 2HNO3 → 3PbSO4 + 2NO2 + H2O
Реакция сопровождается эволюцией коричнево-красного газа, который является диоксидом азота (NO2). Для подтверждения этого факта, можно провести проверку наличия раздражающего запаха этого газа.
Реакция азотной кислоты с оксидом свинца широко используется в аналитической химии для определения наличия свинца в растворах или пробах. Результатом реакции является образование осадка сульфата свинца, который легко обнаруживается и измеряется при помощи различных методов аналитической химии.
Вопрос-ответ

Какие особенности имеет реакция кислот с оксидами металлов?
Реакция кислот с оксидами металлов имеет свои особенности. Во-первых, она является экзотермической, то есть сопровождается выделением тепла. Во-вторых, в результате реакции образуется соль и вода. Также стоит учитывать, что оксид металла может иметь разное степень окисления, что влияет на характер реакции с кислотой.
Какой механизм протекает при реакции кислот с оксидами металлов?
Механизм реакции кислот с оксидами металлов связан с образованием кислотного оксида. Сначала происходит протекание протолитической реакции, при которой оксид металла диссоциирует, освобождая оксидные и гидроксильные ионы. Затем оксидные ионы соединяются с протоноами кислоты, образуя нейтральные оксокислоты. Оксидные и гидроксильные ионы, в свою очередь, реагируют с водой, образуя гидроксиды металлов. В результате реакции получается соль и вода.
