Реакция кислот с металлами является одним из основных химических процессов, которые происходят в природе и используются в промышленности. Такая реакция называется реакцией окисления-восстановления, поскольку при ней происходит окисление кислорода и восстановление металла.
Окисление - это процесс, при котором атомы металла теряют электроны, а восстановление - процесс, при котором электроны передаются с одного вещества на другое. В случае реакции кислоты с металлом, кислород из кислоты принимает электроны от металла, вызывая его окисление, а сама кислота восстанавливается.
Конкретное название реакции зависит от всех веществ, участвующих в процессе. Например, реакции кислот с щелочными металлами (например, натрием или калием) называются реакциями нейтрализации, поскольку при них образуется соль и вода. Реакции кислот с активными металлами (такими как магний или цинк) называются однородными реакциями, поскольку происходят без промежуточных изменений структуры веществ.
Основные типы реакций кислот с металлами
Реакция кислот с металлами - это химический процесс, при котором происходит взаимодействие кислоты с металлом с образованием соли и выделением водорода.
Одним из основных типов реакций кислот с металлами является реакция соляной кислоты с металлами. При этом образуется соответствующая соль хлористого металла и выделяется водородный газ. Например, реакция соляной кислоты с цинком приводит к образованию хлорида цинка и выделению водорода:
2HCl + Zn → ZnCl2 + H2
Вторым основным типом реакций кислот с металлами является реакция серной кислоты с металлами. В результате этой реакции образуется соответствующая соль серы и выделяется водородный газ. Например, реакция серной кислоты с железом приводит к образованию сульфата железа и выделению водорода:
H2SO4 + Fe → FeSO4 + H2
Третий тип реакций кислот с металлами - это реакция азотной кислоты с металлами. При этом образуется соответствующая соль азотной кислоты и выделяется водородный газ. Например, реакция азотной кислоты с медью приводит к образованию нитрата меди и выделению водорода:
2HNO3 + 3Cu → 3Cu(NO3)2 + H2
Также возможна реакция кислородной кислоты, фтороводородной кислоты и других кислот с металлами, которые приводят к образованию соответствующих солей и выделению водорода. Каждая из этих реакций имеет свои особенности и характерные уравнения.
Реакция с образованием соли и водорода

Взаимодействие кислот с металлами приводит к образованию солей и выделению водорода. Реакция происходит с образованием химического соединения, называемого солью, и выделением водорода в виде газа.
Кислоты обладают способностью диссоциировать, то есть распадаться на ионы в водном растворе. При взаимодействии с металлами происходит реакция, в результате которой катион металла замещает гидроген, присутствующий в кислоте.
В результате образуется соль, которая состоит из аниона металла и катиона кислоты. Водород, выделенный в процессе реакции, образует газообразную фазу.
Примером такой реакции может служить взаимодействие соляной кислоты (HCl) с цинком (Zn):
- Исходные реагенты: HCl + Zn
- Реакция: 2HCl + Zn → ZnCl2 + H2
- Образовавшаяся соль: хлорид цинка (ZnCl2)
Такие реакции с образованием соли и водорода широко применяются в различных областях, включая химическую промышленность, производство удобрений и технологические процессы.
Образование сульфатов и селитр
Реакция кислот с металлами приводит к образованию различных солей, в том числе сульфатов и селитр. Сульфаты образуются при реакции кислоты с металлическими оксидами или гидроксидами, содержащими серу. Например, реакция серной кислоты с гидроксидом железа(II) приводит к образованию сульфата железа(II).
Реакция кислоты с металлом, содержащим азот, может привести к образованию селитра. Селитр является нитратом металла и может иметь различные примеси, такие как нитрат калия, нитрат натрия и так далее. Например, реакция азотной кислоты с металлическим натрием приводит к образованию нитрата натрия.
Образование сульфатов и селитр при реакции кислот с металлами имеет важное значение в химической промышленности и сельском хозяйстве. Сульфаты используются в производстве удобрений, а селитры широко применяются как компоненты взрывчатых веществ и удобрений. Они также обладают антисептическими свойствами и могут находить применение в медицине.
Металлы, не реагирующие с кислотами
Некоторые металлы обладают химической инертностью и не реагируют с кислотами. Это связано с их электрохимической стабильностью и способностью образовывать защитные оксидные пленки на своей поверхности.
Один из таких металлов – золото. Оно не окисляется воздействием большинства кислот, включая соляную, уксусную и серную кислоты. Золото также устойчиво к растворению в концентрированных кислотах.
Платина также является примером металла, не реагирующего с кислотами. Она не окисляется при действии соляной, уксусной и серной кислот. Кроме того, платина обладает высокой коррозионной стойкостью и устойчива к агрессивным средам.
Серебро – еще один металл, не реагирующий с кислотами. Оно устойчиво к действию соляной кислоты, но может растворяться в оксидирующих кислотах, таких как азотная и хлорная кислоты.
Нереагирующие с кислотами металлы широко применяются в различных отраслях, включая ювелирное производство, химическую промышленность и электронику. Их устойчивость к кислотам делает их незаменимыми в условиях обработки и хранения агрессивных сред.
Реакция с образованием оксида металла и водной среды

При взаимодействии кислот с металлами происходит реакция, в результате которой образуется оксид металла и выделяется водород. Это явление называется реакцией металла с кислотой.
В процессе реакции ионы металла сотрудничают с ионами водорода и кислотными ионами. Как правило, в реакции участвуют активные металлы, такие как натрий, калий, магний или железо.
Реакция происходит по следующей схеме: металл обменивает свои ионы с ионами водорода в кислой среде, что приводит к образованию оксида металла и выделению водорода в виде пузырьков. При этом оксид металла, в зависимости от вида металла и кислоты, может иметь различные цвета и свойства.
Оксиды металлов обладают различными свойствами и широко используются в различных отраслях промышленности. Они могут иметь кислотные, щелочные или амфотерные свойства, в зависимости от их состава и химических соединений. Также оксиды металлов часто используются в процессе синтеза различных соединений и материалов.
Таким образом, реакция с образованием оксида металла и водной среды при взаимодействии кислот с металлами играет важную роль в химии и имеет множество практических применений.
Реакция с образованием хлористого гидрогена
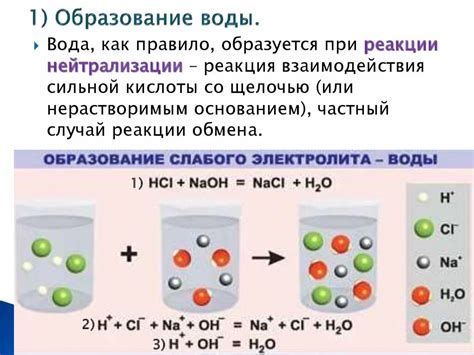
Реакция кислоты с металлом, таким как цинк или железо, может привести к образованию хлористого гидрогена. Данная реакция происходит при контакте металла с кислотой, содержащей хлористую кислоту (HCl).
В ходе реакции между металлом и кислотой происходят ионные процессы. Металл отдает электроны, образуя положительные ионы, которые растворяются в растворе кислоты. В то же время, HCl диссоциирует на положительные ионы водорода (H+) и отрицательные ионы хлора (Cl-).
В результате соединения положительных ионов металла и отрицательных ионов хлора образуется хлорид металла, например, хлорид цинка (ZnCl2) или хлорид железа (FeCl2). В свою очередь, водородные ионы образуют молекулы HCl, которые могут раствориться в воде или выделяться в виде газа HCl.
Газообразный хлористый гидроген имеет острый запах, хорошо растворяется в воде и обладает хорошей растворимостью в неорганических растворителях. Часто этот газ используется в химической промышленности для производства различных хлоридов и других соединений.
Реакция с образованием азотной кислоты
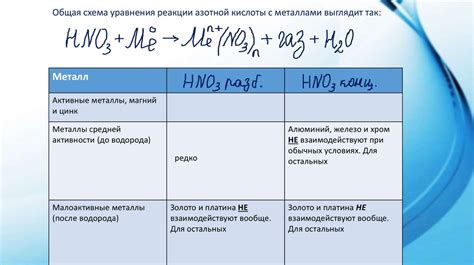
При взаимодействии металлов с азотной кислотой происходит реакция, в результате которой образуется азотная кислота.
Азотная кислота (HNO3) является одним из наиболее распространенных и хорошо изученных соединений азота. Она представляет собой бесцветную жидкость с характерным едким запахом.
Реакция металлов с азотной кислотой является одной из основных химических реакций, которые можно наблюдать в химической лаборатории. Данная реакция относится к типу окислительно-восстановительных реакций. Металлы обладают способностью отдавать электроны, а азотная кислота является окислителем, способным принимать электроны.
В результате взаимодействия металлов с азотной кислотой образуется азотат металла (MNO3) и выделяется нитрогеноксид (NO). Нитрогеноксид образует красно-бурый газ, который хорошо заметен благодаря своему отчетливому запаху. Нитрогеноксид также является окислителем и может участвовать в других химических реакциях.
Реакция металлов с азотной кислотой может быть представлена в виде химического уравнения:
- Металл + HNO3 → MNO3 + NO + H2O
Примером такой реакции может служить взаимодействие меди с азотной кислотой, при котором образуется нитрат меди и нитрогеноксид:
- 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Вопрос-ответ

Что такое реакция кислот с металлами?
Реакция кислот с металлами - это химическая реакция, которая происходит между кислотами и металлами, в результате которой образуются соли и выделяется водород.
Как называют реакцию кислот с металлами?
Реакцию кислот с металлами называют металлоокислительной реакцией.
Что происходит в реакции кислот с металлами?
В реакции кислот с металлами происходит образование солей и выделение газа, чаще всего водорода.
Какие металлы реагируют с кислотами?
Реагируют с кислотами активные металлы, такие как алюминий, цинк, железо и др. Они образуют соли и выделяются водород.
Как можно использовать реакцию кислот с металлами в повседневной жизни?
Реакцию кислот с металлами можно использовать для получения нужных солей или водорода. Например, в производстве удобрений или при использовании водорода в промышленности.
