Кислоты являются одними из наиболее распространенных химических соединений и играют важную роль в нашей повседневной жизни. Они используются в промышленности, медицине, бытовых целях и в многих других отраслях. Одним из интересных аспектов изучения кислот является взаимодействие с металлами. В результате таких реакций образуются разнообразные соединения, часто сопровождающиеся изменением внешнего вида и свойств металла.
Наблюдение реакции кислот с металлами позволяет исследователям изучать химическую активность обоих компонентов. Зачастую, при контакте металла с кислотой, происходит выделение газа и изменение цвета раствора. Например, при добавлении цинка в раствор соляной кислоты наблюдается выделение пузырей водорода и появление белого осадка цинка хлорида. Такое наблюдение свидетельствует о проходящей реакции между цинком и соляной кислотой.
Другим примером является реакция железа с соляной кислотой. При этом происходит образование газа, окрашивающего раствор в зеленый цвет. Это свидетельствует о проходящей реакции, в результате которой образуется гидрогенид железа. Таким образом, наблюдение реакции кислот с металлами позволяет не только увидеть результаты химической реакции, но и сделать выводы о ее характере и протекании.
Понятие реакции кислот с металлами

Реакция кислот с металлами представляет собой химический процесс, при котором кислота взаимодействует с металлическими элементами, образуя соли и выделяя водородный газ.
Процесс реакции кислот с металлами является одной из основных реакций химической кинетики и подробно изучается в рамках школьной химии. Реакция осуществляется посредством взаимодействия активного водорода, содержащегося в кислоте, с металлом, что приводит к образованию соли металла и выделению водорода.
Реакция кислот с металлами может представлять также практическую ценность при получении важных химических соединений или применении в сфере технологии. Одним из примеров реакции является взаимодействие ортовантимоновокислой кислоты с алюминием, в результате которого образуется пирофосфат алюминия и вода. Этот процесс находит применение в производстве силиката кальция, который широко используется в строительстве и других отраслях промышленности.
Также стоит упомянуть о различных способах контроля реакции кислот с металлами, например, использование индикаторов, которые меняют цвет в зависимости от pH-значения раствора. Такие индикаторы помогают определить конкретные характеристики реакции и использовать ее в различных технических процессах.
Вида наблюдаемых реакций

При взаимодействии кислот с металлами происходят различные виды реакций. Они могут быть экзотермическими, сопровождающимися выделением тепла, или эндотермическими, сопровождающимися поглощением тепла.
Одним из наиболее распространенных типов реакций является выделение газа. В процессе взаимодействия кислоты с металлом может образовываться водород, который воспламеняется при прикосновении к источнику огня.
Также возможны реакции, при которых образуются соли. Например, при взаимодействии серной кислоты с медью образуется сульфат меди, который обладает характерным сине-зеленым цветом.
Реакции кислот с металлами иногда сопровождаются выделением тепла и образованием пены. Это происходит при взаимодействии хлороводородной кислоты с алюминием или цинком. При этом образуется хлорсодержащий соли, а также оксиды алюминия или цинка.
Часто можно наблюдать реакцию металлов с кислотами по изменению цвета раствора. Например, при взаимодействии хлорной кислоты с ферроусольфатом раствор приобретает желто-коричневую окраску.
Механизм взаимодействия металлов с кислотами

Взаимодействие металлов с кислотами осуществляется путем обмена протонов между частицами кислоты и металла. Этот процесс протекает по механизму ионно-атомного обмена.
Сначала ионизированная форма кислоты, в которой протоны легко отделяются, вступает в контакт с поверхностью металла. Затем металл, обладающий способностью к взаимодействию с кислотами, принимает протоны из кислоты и образует положительно заряженные ионы, которые присоединяются к поверхности металла.
Далее происходит реакция образованных ионов металла с ионами кислоты, которая может проходить различными способами. Например, металл может реагировать с кислотой, образуя соль и выделяя газ. Также возможна реакция образования кислого оксида металла или гидрида металла.
Механизм взаимодействия металлов с кислотами зависит от таких факторов, как активность металла, концентрация кислоты, температура реакции и наличие катализаторов. Различные металлы имеют разную активность и способность реагировать с кислотами, поэтому эти факторы влияют на скорость и характер реакции.
Возможность использования реакции для получения водорода
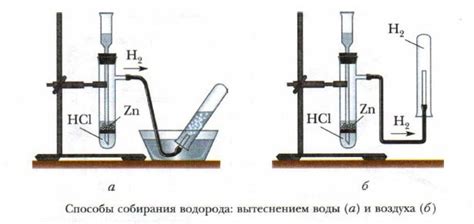
Реакция металлов с кислотами является эффективным способом получения водорода. Когда металл вступает в контакт с кислотой, происходит химическая реакция, в результате которой выделяется водородный газ.
Водородный газ, полученный из реакции металла с кислотой, может быть использован в различных областях. Например, он может быть использован в процессе производства аммиака и синтеза различных органических соединений.
Одним из наиболее распространенных примеров использования реакции металла с кислотой для получения водорода является использование этого газа в водородных топливных элементах. Водородные топливные элементы являются экологически чистым источником энергии, так как при их работе в результате горения водородной смеси не выделяется углекислый газ, а продуктом реакции является только вода.
Также, реакцию металла с кислотой можно использовать для получения водорода в экспериментальных целях или в реакционных системах, где требуется наличие чистого водорода.
Особенности реакции кислот с щелочными металлами

Реакция кислот с щелочными металлами представляет собой одну из наиболее изученных и широко применяемых химических реакций. Щелочные металлы, такие как натрий, калий и литий, имеют высокую активность и легко реагируют с кислотами.
Главной особенностью реакции кислот с щелочными металлами является образование солей и выделение газа в виде пузырьков. Кислоты вступают в химическую реакцию с металлами, образуя ионы металла и ионы водорода. В результате этой реакции образуется соль, которая растворяется в воде и дают специфический вкус. Газ, выделяющийся в виде пузырьков, является водородом.
Реакция кислот с щелочными металлами происходит с выделением тепла. Это связано с энергией, выделяющейся в процессе разрушения связей между атомами кислорода и водорода, а также образования новых связей между ионами кислоты и металла. Энергия, выделяющаяся в результате реакции, может быть использована для нагрева вещества или приводить к повышению его температуры.
Реакция кислот с щелочными металлами является важным процессом в промышленности и научных исследованиях. Этот тип реакций используется для получения солей, очистки растворов от загрязнений, а также в процессах производства электролитов для батарей и других электрохимических устройств.
Процессы образования солей при реакции кислот с металлами
Реакция кислот с металлами приводит к образованию солей. Кислоты являются химическими соединениями, обладающими кислотными свойствами, а металлы – элементами, характеризующимися металлическими свойствами. В процессе реакции кислота передает протон металлу, образуя соль и выделяя молекулы воды.
Образование солей при реакции кислот с металлами происходит в соответствии с общей химической формулой: кислота + металл → соль + водород. Например, реакция соляной кислоты с цинком приводит к образованию хлорида цинка и выделению водорода по следующему уравнению: HCl + Zn → ZnCl2 + H2.
Соли, образующиеся в результате реакции кислот с металлами, имеют различные свойства и могут быть использованы в различных областях. Например, некоторые соли являются основными компонентами пищевых добавок, таких как йодид натрия, который используется в качестве йодированной соли для профилактики йододефицитных заболеваний. Другие соли находят применение в медицине, промышленности и сельском хозяйстве.
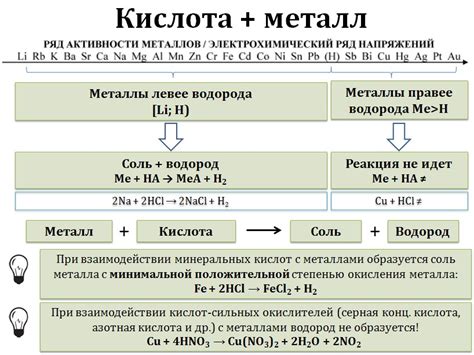
Важно отметить, что реакция между кислотами и металлами может протекать только при наличии достаточной активности металла. Некоторые металлы, такие как золото и серебро, являются стабильными и не реагируют с большинством кислот. Однако активные металлы, например, алюминий и магний, могут реагировать с кислотами, образуя соли и выделяя газы.
Сравнение скорости реакции различных металлов с кислотами

Реакция металлов с кислотами является одной из основных химических реакций, которая часто используется в лаборатории для изучения свойств различных металлов. Кислоты обладают особенностью реагировать с различными металлами, образуя соли и выделяя водород. Однако скорость реакции может существенно различаться в зависимости от металла и кислоты, используемых в эксперименте.
Наиболее активными металлами, которые реагируют с кислотами очень быстро, являются щелочные металлы, такие как натрий (Na) и калий (K). Образующийся водород очень интенсивно выделяется в виде пузырей. Эти металлы обладают высокой химической активностью и быстро окисляются во взаимодействии с кислотами.
Другие металлы, такие как магний (Mg), цинк (Zn) и железо (Fe), также реагируют с кислотами, но уже с меньшей скоростью. Водород выделяется в меньшем количестве, а реакция протекает более плавно. Эти металлы также обладают химической активностью, но не настолько высокой, как у щелочных металлов.
Некоторые металлы, такие как свинец (Pb) и медь (Cu), не реагируют с кислотами при обычных условиях. Они обладают низкой химической активностью и не окисляются в контакте с кислотами. Однако, при высокой концентрации кислоты или при наличии особых условий, эти металлы могут быть окислены и реагировать с кислотами.
Сравнение скорости реакции различных металлов с кислотами позволяет провести анализ химической активности металлов и их способности взаимодействовать с кислотами. Эта информация может быть полезной для определения применимости металлов в различных химических процессах и позволяет установить, какие металлы реагируют быстро, а какие медленно.
Влияние концентрации кислоты на скорость реакции с металлами

Кислоты являются важными химическими соединениями, которые могут взаимодействовать с металлами, образуя реакции. Эти реакции могут происходить в различных условиях, включая изменение концентрации кислоты. Концентрация кислоты оказывает влияние на скорость химической реакции с металлами.
Скорость реакции между кислотой и металлом может быть увеличена с увеличением ее концентрации. При повышенной концентрации кислоты молекулы кислоты сталкиваются с поверхностью металла чаще и с большей энергией, что способствует увеличению вероятности и скорости реакции. Таким образом, увеличение концентрации кислоты может привести к ускорению реакции с металлами.
Однако, существует зависимость между концентрацией кислоты и скоростью реакции, которая может быть нелинейной. Изначально, при низкой концентрации кислоты, скорость реакции с металлами может быть низкой из-за недостаточной числа столкновений молекул кислоты с поверхностью металла. Однако, при дальнейшем увеличении концентрации кислоты, скорость реакции сначала увеличивается до достижения максимальной скорости, а затем может стабилизироваться или даже снижаться.
Также, следует отметить, что концентрация кислоты может влиять на характер реакции с металлами. Например, при низкой концентрации, реакция может протекать с образованием слабого водорода, а при высокой концентрации - с образованием сильного водорода и более интенсивными физическими проявлениями, такими как пена или шипение.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Реакция металлов с кислотами происходит только с активными металлами. К ним относятся щелочные металлы, такие как натрий (Na), калий (K), литий (Li), и щелочноземельные металлы, такие как магний (Mg), алюминий (Al), цинк (Zn), железо (Fe) и свинец (Pb). Они реагируют с кислотами, образуя соли и выделяя водород.
Что происходит при реакции металлов с кислотами?
При реакции металлов с кислотами образуются соли и выделяется водород. Металлы отдают электроны и окисляются, а водородные ионы принимают электроны и восстанавливаются. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка (ZnCl2) и выделению водорода (H2).
Почему активные металлы реагируют с кислотами?
Активные металлы реагируют с кислотами, потому что они обладают низкой энергией ионизации. Это означает, что они легко отдают электроны, чтобы стать положительно заряженными ионами. Когда активный металл реагирует с кислотой, он отдает электроны в водородные ионы кислоты, образуя металлические ионы и соль. Эта реакция происходит из-за разности в электроотрицательностях металла и водорода.
