Кислород — это один из самых распространенных элементов на Земле и играет важную роль в химии. Несмотря на его высокую реакционность, кислород способен образовывать различные соединения с металлами и неметаллами. Эти соединения имеют различные химические свойства, которые определяют их уникальные характеристики и применение в различных областях.
Соединения кислорода с металлами, известные как оксиды, являются одними из самых широко распространенных соединений в природе. Оксиды металлов обладают высокой термической и электрической проводимостью, что делает их незаменимыми в промышленности и технике. Кроме того, некоторые оксиды имеют специфические свойства, такие как блеск или цвет, что делает их привлекательными для использования в качестве пигментов или катализаторов.
Соединения кислорода с неметаллами, такие как оксиды неметаллов и кислородные кислоты, обладают совершенно другими свойствами. Они могут быть очень реакционными и иметь кислотные свойства, способные образовывать соли или взаимодействовать с основаниями. Некоторые из этих соединений обладают ярким цветом и используются в качестве красителей или фотохромных материалов. Кислородные кислоты, такие как серная кислота и азотная кислота, имеют широкое применение в промышленности и химической лаборатории в качестве сильных кислот и окислителей.
Реакция кислорода с металлами
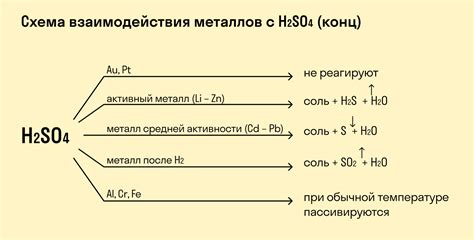
Кислород - активный химический элемент, который может образовывать соединения с большинством металлов. Реакция кислорода с металлами может происходить при нагревании, взаимодействии с водой или другими реагентами.
Одной из наиболее известных реакций кислорода с металлами является окисление, или горение металла в кислороде. При этом происходит выделение тепла и образование оксида металла. Некоторые металлы, такие как натрий или магний, горят с ярким пламенем при контакте с кислородом.
В реакции кислорода с металлами обычно образуются основные оксиды, которые имеют щелочную реакцию и растворяются в воде с образованием щелочей. Например, оксид натрия (Na2O) реагирует с водой, образуя щелочь (NaOH).
Реакция кислорода с металлами также может включать образование перекисей или оксокислов. Например, при взаимодействии кислорода с медью образуется черный оксид (CuO), который при нагревании в воздухе превращается в красную перекись меди (Cu2O).
Важно отметить, что реакция кислорода с металлами может протекать только при наличии кислорода и подходящих условиях. При сохранении металлов в атмосфере, некоторые металлы могут образовывать пассивную оксидную пленку, которая предотвращает дальнейшую реакцию металла с кислородом.
Образование оксидов металлов
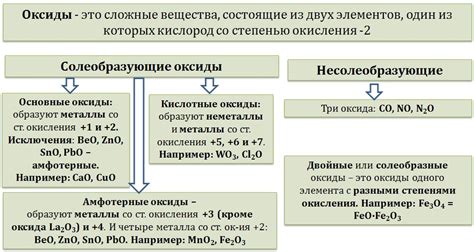
Оксиды металлов являются одними из наиболее распространенных классов неорганических соединений. Они образуются в результате химической реакции металла с кислородом. Эти соединения имеют важное промышленное и научное значение.
Образование оксидов металлов обычно происходит в реакции сильного окислителя - кислородом. При этом металл отдает электроны, образуя положительные ионы, а кислород принимает электроны, превращаясь в отрицательные ионы оксида. Реакция выглядит следующим образом:
Металл + Кислород → Оксид металла
Формула оксида металла зависит от его химического символа, например, оксид железа, FeO, или оксид алюминия, Al2O3.
Оксиды металлов могут быть как кислыми, так и основными. Кислые оксиды образуются от металлов с низкой электроотрицательностью и имеют кислотные свойства. Основные оксиды образуются от металлов с высокой электроотрицательностью и имеют щелочные свойства.
Образование оксидов металлов играет важную роль в различных процессах, таких как окисление металлов, производство керамики, стекла и других материалов, а также в обогащении руд и производстве металлов.
Свойства оксидов металлов
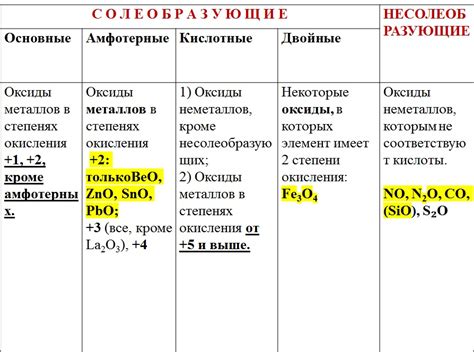
Оксиды металлов представляют собой химические соединения, состоящие из кислорода и металлического элемента. У них есть несколько характерных свойств, которые определяют их основные химические и физические особенности.
Первое свойство оксидов металлов - их часто встречающаяся в природе форма, ведь они образуются при взаимодействии металла с кислородом в атмосфере. Такие оксиды называются природными, и они могут иметь различные степени окисления металла.
Второе свойство - оксиды металлов часто являются основаниями. Они обладают щелочными свойствами и способны реагировать с кислотами, выделяя в результате процесса соль и воду. Такие реакции называются кислотно-щелочными.
Третье свойство оксидов металлов - их способность образовывать кристаллическую решетку. В зависимости от типа металла, оксиды могут образовывать различные типы решетки (например, ионную, координационную или металлическую), что влияет на физические свойства данных соединений.
Четвертое свойство оксидов металлов - они обычно обладают керамической структурой и высокой температурной стойкостью. Благодаря этим свойствам оксиды металлов находят широкое применение в качестве строительных материалов, изоляторов, катализаторов и других сферах индустрии и науки.
Реакция кислорода с неметаллами

Кислород является одним из наиболее активных химических элементов и способен образовывать соединения с большинством неметаллов. В реакциях с неметаллами кислород может выступать как окислителем, получая электроны от неметалла, или как вещество, способное присоединять к себе атомы неметалла.
Одной из наиболее известных реакций кислорода с неметаллами является горение. При горении неметаллы соединяются с кислородом, образуя оксиды. Например, в результате горения угля формируется диоксид углерода (CO2).
Кислород также реагирует с неметаллами при образовании кислородных кислот. В этом случае кислород образует связь с атомами неметаллов, образуя кислородную группу, которая входит в состав кислоты. Например, в результате реакции кислорода с азотом образуется оксид азота (NO), который взаимодействуя с водой, превращается в азотную кислоту.
И наконец, кислород может образовывать соединения с неметаллами, в которых кислород является отрицательно заряженным ангидридом. Например, оксид серы (SO2) и оксид азота (NO2) являются газами с характерным запахом и имеют важное значение в геохимии и экологии.
Образование оксидов неметаллов
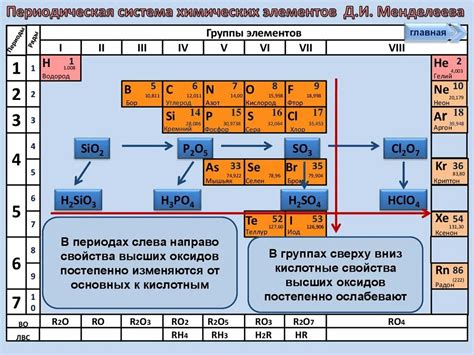
Оксиды неметаллов - это химические соединения, состоящие из атомов неметалла и атомов кислорода. Образование оксидов неметаллов происходит при взаимодействии неметалла с кислородом. Это взаимодействие может происходить при нагревании, окислении или реакции с кислотой.
При взаимодействии с кислородом неметаллы образуют различные оксиды. Например, сера при нагревании с кислородом образует двуокись серы (SO2), а при дальнейшем окислении - трехокись серы (SO3). Азот взаимодействует с кислородом, образуя двуокись азота (NO2). Карбон образует оксид углерода (CO2), который является одним из главных газов в атмосфере.
Оксиды неметаллов обладают различными свойствами. Некоторые оксиды являются газообразными, например, двуокись азота или диоксид серы. Другие оксиды могут быть как газообразными, так и твердыми веществами, например, диоксид углерода (CO2). Оксиды неметаллов могут образовывать кислоты при реакции с водой, что делает их важными в химической промышленности и в жизни человека.
Важно отметить, что оксиды неметаллов обладают кислотными свойствами, в отличие от оксидов металлов, которые обладают щелочными или амфотерными (кислотно-щелочными) свойствами. Кислотные оксиды реагируют с основаниями, образуя соли и воду. Они также растворяются в воде, образуя кислотные растворы. Эти свойства оксидов неметаллов используются в различных отраслях промышленности и научных исследованиях.
Свойства оксидов неметаллов
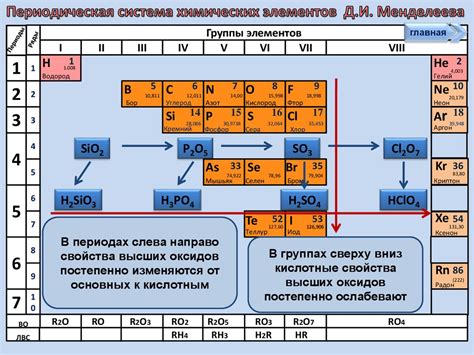
Оксиды неметаллов представляют собой соединения неметалла с кислородом. Они обладают рядом характерных свойств, которые отличают их от оксидов металлов.
Температурная устойчивость: Оксиды неметаллов обычно обладают высокой температурной устойчивостью. Они могут выдерживать высокие температуры без разложения и сохранять свою структуру и свойства.
Кислотность: Оксиды неметаллов обычно обладают кислотными свойствами. Они могут реагировать с водой, образуя кислоты. Некоторые из них растворяются в воде, образуя кислотные растворы.
Реакция с основаниями: Оксиды неметаллов могут реагировать с основаниями, образуя соли. Это происходит благодаря их кислотным свойствам. Реакция оксида неметалла с основанием называется нейтрализационной реакцией.
Состав и структура: Оксиды неметаллов могут иметь различный химический состав и структуру. Они могут быть молекулярными соединениями или формировать кристаллическую решетку. Некоторые оксиды неметаллов могут образовывать полимерные структуры.
Физические свойства: Оксиды неметаллов могут обладать различными физическими свойствами, такими как цвет, запах, твердость и плавление и кипение вещества. Некоторые оксиды неметаллов обладают электрической проводимостью в определенных условиях.
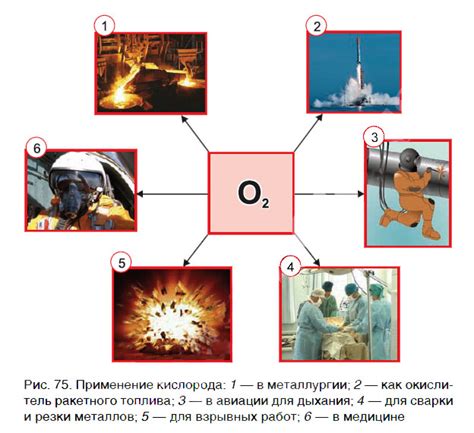
Использование соединений кислорода в промышленности

Соединения кислорода широко используются в промышленности благодаря своим уникальным химическим свойствам. Кислород является одним из главных компонентов воздуха, и его соединения играют важную роль во многих процессах производства.
Одним из основных применений соединений кислорода является их использование в процессе окисления. Кислород обеспечивает эффективную поддержку горения, что делает его неотъемлемым компонентом в процессах сварки и резки металлов. Кроме того, кислород используется в процессах окисления при производстве кислородных сталей и других металлических сплавов.
Соединения кислорода также широко применяются в процессах окисления органических соединений. Окисление с помощью кислорода позволяет получать различные органические продукты, такие как альдегиды, кетоны и карбоновые кислоты. Эти вещества являются важными компонентами многих промышленных продуктов, включая пластмассы, лекарственные препараты и красители.
Кроме того, соединения кислорода используются в промышленности для получения электроэнергии. Процесс электролиза позволяет разлагать воду на кислород и водород при использовании электричества. Полученный кислород используется в производстве стержней для сварки и резки металлов, а водород - в производстве удобрений и водородного топлива.
Также, соединения кислорода используются в производстве синтетических органических веществ, азотных удобрений, сульфата аммония, хлора и многих других продуктов.
Экологические аспекты применения соединений кислорода
Применение соединений кислорода является важной частью многих промышленных процессов. Однако, их использование может сопровождаться определенными экологическими проблемами, которые необходимо учитывать.
Соединения кислорода, такие как оксиды металлов и неметаллов, могут являться потенциально опасными веществами. Они могут загрязнять окружающую среду при их производстве и использовании. Вредные выбросы данных соединений могут быть особенно заметны при работе с большими промышленными масштабами.
Одной из основных проблем, связанных с применением соединений кислорода, является выброс вредных веществ в атмосферу. Это может быть особенно важно при использовании соединений кислорода в производстве металлов, где может существовать риск выброса тяжелых металлов в окружающую среду.
Однако, существуют и технологии, которые могут помочь снизить негативное воздействие на окружающую среду. Например, использование фильтров и других систем очистки в воздухоочистных установках может значительно снизить выбросы вредных веществ.
Также, следует обратить внимание на переработку и утилизацию соединений кислорода. Вместо выбрасывания их в окружающую среду, эти соединения могут быть переработаны или утилизированы с использованием специальных технологий, которые помогут снизить их негативное воздействие на окружающую среду.
В целом, экологические аспекты применения соединений кислорода необходимо учитывать и искать способы минимизации их негативного воздействия на окружающую среду. Важно развивать и внедрять более экологически безопасные методы производства и использования данных соединений, чтобы обеспечить устойчивое и равновесное развитие нашей планеты.
Вопрос-ответ

Какие свойства имеют соединения кислорода с металлами?
Соединения кислорода с металлами, называемые оксидами, обладают различными свойствами в зависимости от металла. В целом, оксиды металлов являются твердыми веществами с высокими температурами плавления и кипения, они обладают высокой теплопроводностью и электропроводностью, а также обладают щелочными свойствами.
Какие свойства имеют соединения кислорода с неметаллами?
Соединения кислорода с неметаллами, такие как оксиды, кислоты и пероксиды, обладают разнообразными свойствами. Например, оксиды неметаллов могут быть газообразными, жидкими или твердыми веществами, они могут обладать кислыми, амфотерными или основными свойствами. Кислоты, в свою очередь, обладают кислотными свойствами и используются в различных химических процессах. Пероксиды обладают окислительными свойствами и широко используются в промышленности.
