Хлороводород (HCl) – одна из наиболее распространенных кислот, широко используемая в промышленности и лабораторных условиях. Она обладает высокой реакционной способностью и может взаимодействовать с различными веществами. В частности, хлороводород способен реагировать с металлами, образуя соли и выделяя водород.
При взаимодействии хлороводорода с металлами происходит окислительно-восстановительная реакция. Металл участвует в реакции как вещество, окисляющееся, а хлороводород – как вещество, восстанавливающееся. В результате реакции образуется соль металла и высвобождается молекулярный водород, который обычно выделяется в виде газа.
Уравнение реакции между металлом М и хлороводородом можно записать следующим образом: М + 2HCl = МCl2 + H2. Здесь "М" обозначает металл, с которым происходит реакция, "HCl" – хлороводород, "МCl2" – соль металла и "H2" – молекулярный водород.
Взаимодействие металлов с хлороводородом

Взаимодействие металлов с хлороводородом является химической реакцией, при которой образуется соль и выделяется водород. Такая реакция обусловлена высокой активностью металлов и их способностью образовывать ионные соединения. Хлороводород, или соляная кислота, является сильным окислителем и может реагировать с металлами, образуя хлорид и выделяя водородный газ.
Взаимодействие различных металлов с хлороводородом может происходить по-разному. Например, щелочные металлы, такие как натрий и калий, реагируют с хлороводородом очень быстро и интенсивно, при этом выделяется большое количество водорода и образуется хлорид металла. Алюминий и цинк также реагируют с хлороводородом, но реакция протекает менее интенсивно, а образующийся водородный газ не такой обильный.
Реакция металлов с хлороводородом имеет практическое применение. Например, металлическая лужа, состоящая из сплава натрия и калия, используется для безопасного хранения и транспортировки хлороводорода. При контакте с хлороводородом сплав реагирует, образуя хлорид натрия и калия и выделяя водородный газ.
Для уравновешивания химического уравнения реакции металла с хлороводородом необходимо учесть коэффициенты стехиометрии. Например, уравнение реакции металла натрия с хлороводородом будет выглядеть следующим образом:
2Na + 2HCl → 2NaCl + H2
Таким образом, взаимодействие металлов с хлороводородом является одной из основных реакций, которая применяется в химии и имеет практическое значение.
Химическая реакция и уравнение реакции

Химическая реакция - это процесс превращения одних веществ в другие. При химической реакции происходит разрыв химических связей в исходных веществах и образование новых связей в образовавшихся продуктах. Химические реакции происходят внутри атомов и молекул, их скорость и характер зависят от ряда факторов, таких как температура, концентрация реагентов и наличие катализаторов.
Уравнение реакции - это способ записи химической реакции с помощью химических формул реагентов и продуктов. В уравнении реакции указывается количество веществ, участвующих в реакции, и их соотношение. Уравнение реакции состоит из двух частей: слева от стрелки записываются исходные реагенты, справа - образовавшиеся продукты. Коэффициенты перед формулами веществ показывают их соотношение в реакции - отношение исходных веществ к продуктам.
Уравнение реакции позволяет описать химическую реакцию на молекулярном уровне и предсказать ее характеристики, такие как количество продуктов, необходимое время для завершения реакции и скорость реакции. Оно также позволяет провести расчеты и определить количество исходных веществ, необходимых для получения заданного количества продукта.
Определение вещества и его свойства
Вещество - это форма материи, имеющая определенные химические и физические свойства. Определение вещества основано на его химическом составе и структуре.
Определение вещества проводится путем исследования его свойств. Свойства вещества - это характеристики, которые имеет данное вещество и по которым оно отличается от других веществ.
Свойства вещества могут быть физическими или химическими. Физические свойства включают такие характеристики, как цвет, запах, температура плавления и кипения, плотность, проводимость, растворимость и т.д. Они измеряются с помощью физических методов и не приводят к изменению химического состава вещества.
Химические свойства вещества характеризуют его способность изменяться под воздействием других веществ или внешних условий. К химическим свойствам относятся реакционная способность, способность окисляться или восстанавливаться, способность образовывать новые соединения и т.д.
Определение вещества и его свойств происходит с помощью различных методов и приборов. Например, химический анализ позволяет определить химический состав вещества, а физические эксперименты позволяют выявить его физические свойства.
Знание свойств вещества является важным для понимания его реакционной способности, применения в различных областях и предсказания его поведения при взаимодействии с другими веществами.
Факторы влияния на скорость реакции
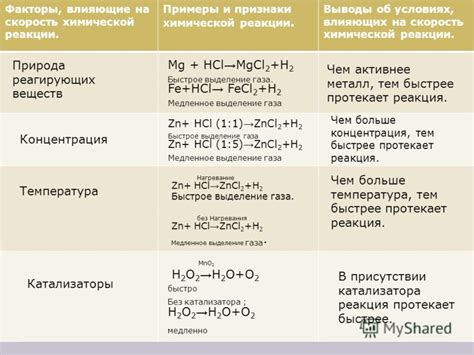
Скорость реакции между металлами и хлороводородом может изменяться под влиянием нескольких факторов. Одним из главных факторов является концентрация реагирующих веществ. Чем выше концентрация металла и хлороводорода, тем больше возможностей для их взаимодействия, и следовательно, тем выше скорость реакции.
Температура также оказывает влияние на скорость реакции. При повышении температуры молекулы металла и хлороводорода обладают большей энергией, что увеличивает вероятность их столкновения и, соответственно, возможность реакции. Поэтому при повышении температуры скорость реакции между металлами и хлороводородом увеличивается.
Поверхность реагентов также влияет на скорость реакции. Если поверхность металла большая, то количество активных центров для реакции увеличивается, что приводит к повышению скорости реакции. Также важно правильно подготовить поверхность металла, например, удалить оксидные пленки, чтобы обеспечить лучший контакт с хлороводородом.
Помимо этих факторов, на скорость реакции между металлами и хлороводородом могут влиять и другие параметры, такие как давление, катализаторы и присутствие растворителей. Все эти факторы изменяют вероятность и условия для наступления реакции и могут существенно влиять на ее скорость.
Применение в промышленности и повседневной жизни

Взаимодействие металлов с хлороводородом имеет широкое применение не только в промышленности, но и в повседневной жизни. Металлы, такие как цинк, алюминий, магний и железо, активно используются в различных областях.
В промышленности эта реакция находит применение в процессах гальванизации, при которой поверх металла создается защитное покрытие, способное предотвратить коррозию. Например, цинковое покрытие наносится на стальные изделия, такие как каркасы зданий, крыши и автомобильные детали, чтобы защитить их от воздействия окружающей среды.
В повседневной жизни взаимодействие металлов с хлороводородом используется в процессе очистки и дезинфекции воды. Например, алюминий взаимодействует с хлороводородом для удаления загрязнений и вредных микроорганизмов из воды в процессе обработки питьевой воды.
Также, эта реакция используется в производстве различных химических соединений, таких как хлориды металлов, которые широко применяются в промышленности для изготовления пигментов, красителей, пластиков, лекарственных препаратов и других продуктов.
В промышленности процесс взаимодействия металлов с хлороводородом также используется для получения водорода, которое является важным сырьем для производства аммиака, метанола, растворителей и других веществ.
Кроме того, данная реакция может применяться в создании батарей, где металлы вступают в реакцию с кислородом и водородом, что приводит к образованию электрической энергии.
Безопасность и меры предосторожности при проведении реакции

Проведение реакции металлов с хлороводородом требует соблюдения определенных мер безопасности и предосторожности для предотвращения возможных рисков и опасностей.
Личная защита:
- Перед началом работы следует использовать защитные очки для защиты глаз от возможных брызг реагентов;
- Рекомендуется носить халат и перчатки из резинового материала для предотвращения контакта реагентов с кожей;
- При работе с опасными веществами необходимо обеспечить хорошую вентиляцию помещения или работать под вытяжным шкафом, чтобы избежать ингаляции вредных паров или газов;
- В случае попадания реактивов на кожу или в глаза, следует незамедлительно промыть их большим количеством воды и обратиться к врачу.
Особые меры предосторожности:
- Реакция металлов с хлороводородом может сопровождаться выделением взрывоопасных газов, таких как водород. Поэтому рекомендуется работать в открытом пространстве или под вытяжным шкафом, чтобы избежать скопления газов в закрытом помещении;
- Для предотвращения риска возгорания необходимо избегать контакта металлов с огнем или нагреванием;
- Не рекомендуется проводить данную реакцию с металлами, которые могут быть реактивными или являются токсичными, такими как натрий, калий или ртуть;
- При проведении реакции стоит быть осторожным и внимательным, следить за течением процесса и не допускать потери контроля над ситуацией.
Соблюдение указанных мер безопасности и предосторожности при проведении реакции металлов с хлороводородом поможет предотвратить возникновение опасных ситуаций и обеспечить безопасное проведение эксперимента.
Вопрос-ответ

Что происходит при взаимодействии металлов с хлороводородом?
При взаимодействии металлов с хлороводородом происходит реакция, в результате которой образуется соль металла и выделяется водород.
Каково уравнение реакции взаимодействия металлов с хлороводородом?
Уравнение реакции взаимодействия металлов с хлороводородом имеет общий вид: Металл + HCl → Соль металла + H2
