Реакция двухвалентного металла с кислородом является важным процессом в химии и имеет широкое применение в различных областях науки и промышленности. Металлы, обладающие двухвалентным состоянием, имеют два электронных уровня заполненных электронами. Этот параметр влияет на их химическую активность и способность реагировать с другими элементами.
Взаимодействие двухвалентного металла с кислородом приводит к образованию оксида металла. Оксиды являются основными соединениями металлов с кислородом и обладают различными физическими и химическими свойствами. Реакция металла с кислородом может протекать как под действием высоких температур, так и при обычных условиях.
Важно отметить, что каждый двухвалентный металл обладает своими особенностями в реакции с кислородом. Некоторые металлы могут образовывать не только оксиды, но и пероксиды, что отражается на их химических свойствах и способностях к реакции с другими веществами. Кроме того, реакция металла с кислородом может протекать с различной скоростью, что также зависит от конкретного металла и условий реакции.
Процесс окисления металлов

Окисление металлов является одним из основных процессов, происходящих в природе и любой системе, где присутствует кислород. В результате взаимодействия металлов с кислородом образуются оксиды, которые часто являются нежелательными соединениями.
В процессе окисления двухвалентных металлов, таких как железо, медь, никель и другие, их атомы переходят в двухвалентное состояние, при этом теряя один или несколько электронов. Такие реакции являются редокс-реакциями, где происходит одновременное окисление и восстановление металла.
Окисление металлов происходит наличием кислорода в атмосфере, а также вода и влага являются катализаторами реакции. Поверхность металла покрывается тонкой пленкой оксида, которая может быть защитной, например, оксид алюминия на поверхности алюминия, или незащитной, как оксид железа на поверхности железа, который способствует дальнейшему окислению металла.
Процесс окисления металлов имеет важное значение в промышленности и технике. Ржавчина, которая является результатом окисления железа, наносит большой ущерб металлическим конструкциям, оборудованию и машинам. Для защиты от окисления металлов используют различные методы, такие как покрытие поверхности металла защитными пленками или использование антиоксидантов.
Металлы и их электрохимические свойства

Металлы - это класс веществ, обладающих высокой электропроводностью, пластичностью и теплопроводностью. Одной из важных характеристик металлов является их электрохимическая активность.
Электрохимическое поведение металлов определяется их способностью образовывать положительно заряженные ионы (катионы) в растворе. Это происходит благодаря отдаче электронов из внешней оболочки металла, что ведет к образованию положительно заряженного ионного ядра и свободных электронов, которые становятся свободными и неподвижными, и обуславливают электропроводность металлов.
Также, металлы обладают свойством давать электроны при образовании химических связей, что позволяет им проявлять окислительные свойства. К примеру, металлы могут реагировать с кислородом, образуя оксиды. Эта реакция происходит при высоких температурах и сопровождается выделением энергии.
В электрохимических процессах металлы могут выступать в качестве анодов или катодов в электрохимической ячейке. Анод - это электрод, на котором происходит окисление, то есть отдача электронов, в то время как катод - это электрод, на котором происходит восстановление, то есть прием электронов. Данный процесс является основой для работы батареек, аккумуляторов и других электрохимических устройств.
В общем, электрохимические свойства металлов позволяют использовать их в различных технологических и энергетических процессах, а также в производстве различных предметов, от инструментов до ежедневных бытовых предметов. Они являются неотъемлемой частью нашего современного мира и играют важную роль во многих областях жизни.
Характеристики двухвалентных металлов
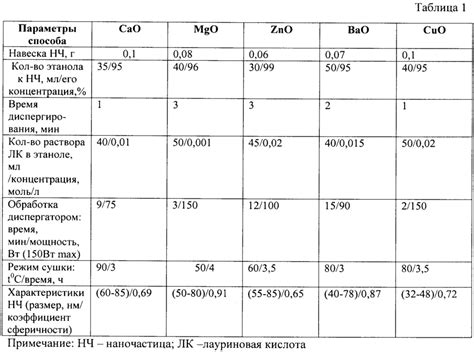
Двухвалентные металлы - это металлы, которые способны образовывать соединения с кислородом в двух степенях окисления. Они обладают определенными характеристиками, которые делают их особенными в реакциях с кислородом.
Во-первых, двухвалентные металлы обладают высокой реакционной способностью с кислородом. Это связано с тем, что они имеют два электрона в валентной оболочке, которые легко могут участвовать в химических реакциях.
Во-вторых, двухвалентные металлы могут образовывать стабильные соединения с кислородом. Это связано с тем, что они обладают определенной электроотрицательностью и способностью образовывать ковалентные связи с кислородом.
В-третьих, двухвалентные металлы обладают различными окрашивающими свойствами, что позволяет использовать их в различных сферах. Например, многие двухвалентные металлы образуют окрашенные оксиды, которые используются в производстве красок и пигментов.
Таким образом, характеристики двухвалентных металлов, включая высокую реакционную способность с кислородом, способность образовывать стабильные соединения и различные окрашивающие свойства, делают их важными и интересными объектами изучения. Их свойства и реакции с кислородом играют значимую роль в многих сферах науки и промышленности.
Взаимодействие двухвалентных металлов с кислородом

Взаимодействие двухвалентных металлов с кислородом является одной из важных реакций в химии. Это процесс, когда металл вступает в контакт с молекулами кислорода и претерпевает химические изменения.
Одним из примеров такой реакции является окисление двухвалентных металлов, таких как железо, медь, марганец и титан. В результате этого процесса металл образует оксид, который является соединением с кислородом. Этот оксид может иметь различные свойства, в зависимости от химической природы металла.
Взаимодействие двухвалентных металлов с кислородом может протекать как при высоких температурах, так и при обычных условиях. Например, при нагревании железа в присутствии кислорода происходит образование ржавчины – оксида железа. Это явление повседневно наблюдается на поверхности различных металлических предметов.
Взаимодействие двухвалентных металлов с кислородом также может быть использовано в промышленности. Например, оксиды меди широко применяются в качестве катализаторов в различных химических процессах. Кроме того, окисленные формы металлов могут обладать специфическими свойствами, которые могут быть полезными в различных отраслях науки и техники.
Таким образом, взаимодействие двухвалентных металлов с кислородом представляет собой важный процесс в химии. Он приводит к образованию оксидов металлов, которые могут быть использованы для различных целей. Это явление имеет практическое применение и может быть детально изучено в ходе научных исследований.
Образование оксидов в результате реакции

Образование оксидов в результате реакции двухвалентного металла с кислородом является одной из основных химических реакций, происходящих в природе. Оксиды представляют собой химические соединения, состоящие из металла и кислорода. Реакция между двухвалентным металлом и кислородом приводит к образованию различных типов оксидов, характеризующихся различной степенью окисления и свойствами.
Образование оксидов происходит при взаимодействии кислорода с двухвалентным металлом путем обмена электронами. В результате этой реакции, металл отдает два электрона, а кислород принимает их. Таким образом, образуется стабильное химическое соединение – оксид. Степень окисления металла в оксиде может быть различной, что определяется его химическими свойствами и расположением в периодической системе.
Оксиды, образующиеся в результате реакции двухвалентного металла с кислородом, имеют разнообразные свойства и применения. Некоторые из них являются основными, т.е. обладают щелочными свойствами и способны реагировать с кислотами, образуя соли и воду. Другие оксиды могут быть кислотными и реагировать с основаниями, образуя соли и воду. Есть также оксиды, которые не растворяются в воде и не обладают ни кислотными, ни щелочными свойствами.
Образование оксидов имеет широкую практическую значимость. Оксиды используются в различных отраслях промышленности, в процессе получения сплавов и полупроводниковых материалов, в качестве катализаторов и веществ для окраски. Кроме того, некоторые оксиды имеют важное значение для живых организмов, например, магниевокислый кальций является необходимым компонентом для создания костной ткани.
Роль двухвалентных металлов в промышленности

Двухвалентные металлы играют важную роль в различных отраслях промышленности благодаря своим уникальным свойствам и химическому поведению.
Один из самых распространенных двухвалентных металлов - железо. Его широко используют в металлургии и строительстве. Железо является основным компонентом стали, одного из наиболее востребованных строительных материалов. Оно также применяется в производстве автомобилей, машин и различных инженерных конструкций.
Никель и цинк - еще два двухвалентных металла, которые широко используются в промышленности. Никель используется в производстве различных металлических изделий, включая нержавеющую сталь, электро- и авиационные промышленные изделия, а также химические соединения. Цинк применяется в гальванике, защитном покрытии металлических изделий от коррозии, производстве аккумуляторов, сплавов и других материалов.
Медь является еще одним важным двухвалентным металлом, используемым в различных промышленных секторах. Она применяется в электротехнике, производстве проводов, электронных компонентов, медных труб и различных деталей с высокой теплопроводностью. Медные сплавы находят применение в изготовлении монет, ювелирных изделий и многое другое.
Свинец и кадмий - также востребованные двухвалентные металлы в промышленности. Они отличаются хорошей пластичностью и применяются в производстве аккумуляторов, кабелей, покрытий для коррозионной защиты и других материалов. Некоторые соединения свинца и кадмия используются в производстве стекла, эмалей и керамики.
В заключение, двухвалентные металлы играют неотъемлемую роль в промышленности, обеспечивая производство различных материалов и изделий. Их химические и физические свойства делают их незаменимыми для многих отраслей промышленности и способствуют развитию технологий и производства эффективных и инновационных продуктов.
Практическое применение результатов исследований

Результаты исследований реакции двухвалентного металла с кислородом имеют значительное практическое применение в различных областях.
В металлургической промышленности эти результаты помогают разрабатывать новые сплавы, которые обладают высокой стойкостью к окислению и коррозии. Такие сплавы находят широкое применение в производстве авиационных и космических материалов, а также во всех областях, где требуется высокая прочность и долговечность изделий.
Исследования в этой области также помогают улучшить процессы утилизации отходов и переработки металлических отходов. Путем искусственного управления окислением металлов можно получать ценные соединения, которые дальше могут быть использованы в промышленности. Например, окисленные формы двухвалентного металла могут служить источниками каталитической активности для различных химических процессов.
Помимо металлургической отрасли, результаты исследований находят применение в области энергетики. Реакция двухвалентного металла с кислородом может использоваться для получения энергии в промышленных и бытовых установках, таких как газовые турбины и печи. В частности, сплавы с определенными свойствами окисления могут использоваться для повышения эффективности сжигания топлива и уменьшения выбросов вредных веществ.
Также результаты исследований имеют значительное значение в области медицины и биологии. Они могут помочь в разработке новых препаратов и лекарств, основанных на окислительно-восстановительных реакциях, в которых участвуют двухвалентные металлы и кислород. Это может привести к созданию новых препаратов для более эффективного лечения различных заболеваний.
Вопрос-ответ

Какие металлы могут реагировать с кислородом?
С кислородом могут реагировать различные металлы, включая двухвалентные металлы, такие как железо, никель, ванадий, хром и др.
Как происходит реакция двухвалентного металла с кислородом?
При реакции двухвалентного металла с кислородом происходит образование оксида металла. Кислород из воздуха вступает во взаимодействие с металлом, что приводит к образованию химического соединения.
