Соли представляют собой соединения, которые образуются при реакции между металлом и кислотой. Химические свойства солей одного металла могут значительно отличаться от свойств других соединений того же металла. Взаимодействие соли с другими веществами и окружающей средой может приводить к интересным и неожиданным результатам.
При высыхании растворов солей металлов образуются кристаллы, которые могут иметь различные формы и цвета. Однако, несмотря на разнообразие внешних свойств, основные химические свойства солей одного металла остаются постоянными. Например, многие соли образуют растворы, которые могут обладать кислотностью или щелочностью, в зависимости от свойств металла.
Одной из основных особенностей реакции солей одного металла является их способность к образованию осадков. Когда соль одного металла растворяется в воде, ее ионы могут соединяться с другими ионами, образуя твердые осадки. Это может происходить в результате образования нерастворимых солей или реакции между ионами из разных растворов.
Например, при смешивании растворов солей металлов может возникнуть химическая реакция, в результате которой образуются новые соединения, представляющие собой нерастворимые осадки. Такие реакции могут происходить даже при наличии малых концентраций ионов.
Часто реакция солей одного металла с другими веществами может привести к изменению цвета раствора или образованию ярких пигментов. Это связано с тем, что ионы металлов, попадая в раствор или образуя осадок, могут обладать специфическими химическими свойствами, включая способность к поглощению и излучению света определенных длин волн.
Формирование комплексных соединений

Соли одного металла являются хорошими ионными соединениями, образующимися в результате взаимодействия кислот и оснований. Однако существует группа солей, которые обладают свойством образовывать комплексные соединения с различными лигандами.
Комплексные соединения образуются при взаимодействии соли с лигандом, который может быть органическим или неорганическим соединением. Лиганды могут образовывать совокупность атомов или ионов, которые присоединяются к металлическому иону и формируют комплексный ион.
Формирование комплексных соединений солей одного металла происходит в результате образования координационных связей между металлическим ионом и лигандом. Координационная связь формируется путем общей электронейтральности, при которой металлический ион отдает электронное облако лиганду. Этот процесс называется координацией, а образовавшийся комплексный ион - координационным соединением.
Механизм формирования комплексных соединений может быть различным, включая ионно-атомный, ионно-молекулярный и атомно-молекулярный механизмы. Важно отметить, что образование комплексных соединений может изменять химические свойства соли, такие как растворимость, степень окисления и активность в химических реакциях. Кроме того, комплексные соединения могут обладать специфическими свойствами, которые можно использовать в различных областях, включая катализ и медицину.
Окислительно-восстановительные реакции
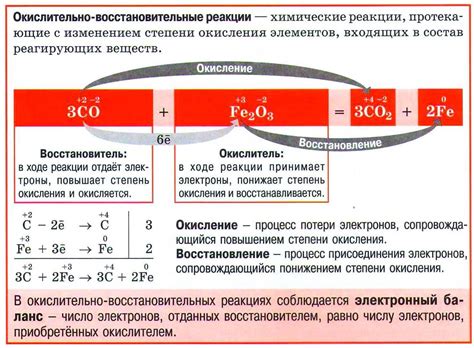
Окислительно-восстановительные реакции (ОВ реакции) - это химические реакции, в которых происходит передача электронов от одного вещества к другому. В этих реакциях одно вещество окисляется, теряя электроны, а другое вещество восстанавливается, получая электроны.
ОВ реакции имеют важное значение в химии солей. Некоторые соли могут действовать как окислители или восстановители в реакциях с другими веществами. Например, соли переходных металлов могут проявлять свои окислительные или восстановительные свойства, образуя соответствующие катионы или анионы.
Важно отметить, что различные соли могут иметь разные степени окисления своих ионов. Это означает, что разные ионы с одним и тем же металлом могут проявлять разные свойства в ОВ реакциях. Например, ионы Fe2+ и Fe3+ могут проявлять разные степени окисления и, соответственно, разные свойства в окислительных или восстановительных реакциях.
ОК реакции с солями одного металла могут протекать как в растворе, так и в твердом состоянии при подходящих условиях. В растворе эти реакции часто протекают более интенсивно из-за большей подвижности ионов. Однако в твердом состоянии ОК реакции могут быть менее интенсивными, поскольку молекулы вещества могут быть менее подвижными.
В целом, ОК реакции с солями одного металла могут проявляться в различных химических свойствах этих соединений. Эти реакции могут иметь важное значение в различных химических процессах и могут использоваться в различных областях, таких как промышленность, металлургия и многие другие.
Взаимодействие с кислотами и щелочами

Соли металлов имеют способность взаимодействовать как с кислотами, так и с щелочами.
Взаимодействие с кислотами происходит путем образования водородной связи между ионами водорода кислоты (H+) и отрицательно заряженными ионами соли. Это приводит к образованию новых соединений – кислотных солей. Например, реакция между солью железа (II) и серной кислотой приводит к образованию сульфата железа (II) и выделению газа – сероводорода (H2S).
Взаимодействие с щелочами, такими как гидроксиды, оксиды и щелочные металлы, также приводит к образованию новых соединений – основных солей. Одной из реакций может быть образование гидроксида металла и соли. Например, реакция между солью кальция и гидроксидом натрия приводит к образованию гидроксида кальция и соли натрия.
В обоих случаях реакции соляных металлов с кислотами и щелочами сопровождаются выделением тепла и изменением различных химических свойств веществ. Эти реакции имеют широкое применение в различных отраслях науки и промышленности, так как позволяют получать новые соединения с определенными свойствами.
Таким образом, взаимодействие солей металлов с кислотами и щелочами является важной составляющей изучения их химических свойств и имеет множество применений в химической промышленности. Это позволяет управлять процессами синтеза новых соединений и использовать полученные продукты для выполнения определенных задач.
Реакции образования осадка

Реакции образования осадка представляют собой процесс образования твердого вещества (осадка) в результате смешивания двух растворов солей одного металла. Эти реакции основаны на образовании нерастворимого вещества из двух реагирующих соединений. Осадок может образовываться в виде мельчайших частиц, не видимых невооруженным глазом, или в виде крупных частиц, образующих непрозрачные или мутные осадки.
Реакции образования осадка могут иметь различные признаки. К числу основных признаков относятся изменение цвета раствора, появление мутности или непрозрачности, формирование осадка на дне реакционной смеси, изменение pH значения раствора и так далее. При этом важно отметить, что образование осадка является необратимой реакцией, то есть осадок невозможно вновь растворить в данном растворе.
Осадки, образующиеся в реакциях, могут иметь различные свойства и составы. В зависимости от солей, реагирующих между собой, образуется разный тип осадка. Например, осадки могут быть белого, желтого, коричневого, черного или иного цвета. Кроме того, осадки могут обладать различной структурой и размерами частиц.
Изучение реакций образования осадка является важной частью химического анализа. С их помощью проводятся качественные и количественные анализы, определяется наличие и концентрация определенных веществ в растворе. Кроме того, реакции образования осадка находят применение в различных областях, таких как фармацевтика, пищевая промышленность, экология и другие.
Реакция с другими металлами
Соли одного металла могут образовывать реакции с другими металлами, что связано с их различными химическими свойствами и реакционной способностью. В таких реакциях, в зависимости от условий и реакционных компонентов, могут происходить различные химические превращения.
Например, одна из распространенных реакций солей металлов - образование осадка при соединении с металлами, обладающими большей реакционной способностью. Это явление называется обратным замещением. Например, эффектное образование осадка может наблюдаться при реакции раствора серебряной соли с никелевой пластинкой, при которой на поверхности никеля образуется серебряное покрытие.
Еще одна интересная реакция - обмен металлов в соли. При этом реакции металл одной соли может замещать металл в другой соли. Например, хлорид меди реагирует с цинком, при этом медь переходит в растворимый хлорид цинка, а цинк выпадает на дно в виде осадка. Это реакция называется двойное разложение.
Также стоит упомянуть о реакциях солей с кислотами. В зависимости от реакционных условий и соотношений компонентов, такие реакции могут протекать с образованием осадка или без него, с выделением газа или без него. Например, реакция серной кислоты с гидроксидом натрия приводит к образованию сульфата натрия и воды, при этом не образуется осадка, но реакция сопровождается выделением тепла.
Вопрос-ответ

Каким образом происходят реакции солей и одного металла?
Реакции солей и одного металла могут происходить различными способами. В зависимости от типа реакции и свойств металла, может происходить обмен ионами между металлом и солью, образование осадка или газовое выделение. Некоторые металлы, такие как цинк или железо, активно реагируют с кислотами, образуя соли и выделяя водород. Другие металлы могут реагировать с растворами солей, образуя осадок или обменные реакции.
Какие могут быть особенности реакции солей и одного металла?
Реакции солей и одного металла могут иметь различные особенности, в зависимости от типа реакции и химических свойств металла. Например, некоторые металлы могут реагировать только с определенными солями, так как их реакция зависит от синергического эффекта между металлом и анионом в соли. Кроме того, некоторые металлы могут образовывать разные соединения с солью в зависимости от условий реакции, например, при разных pH или температуре.
