Азотная кислота (HNO3) — это основное химическое соединение, используемое в промышленности и лабораториях. Ее соединение с металлами - это процесс, известный как нитрирование, который приводит к образованию солей азотной кислоты.
Соединение азотной кислоты с металлами имеет ряд характеристических свойств. Во-первых, образование соединений между азотной кислотой и металлами сопровождается выделением газообразного оксида азота (II). Во-вторых, данные соединения обладают высокой термической устойчивостью и обычно имеют низкую скорость реакции с водой. Кроме того, многие из этих соединений образуют нерастворимые осадки в воде, что обуславливает их использование в качестве катализаторов и пигментов.
Применение соединений азотной кислоты с металлами широко разнообразно. Одним из наиболее важных применений является получение взрывчатых веществ, таких как тринитротолуол (ТНТ). Кроме того, эти соединения используются в качестве удобрений, окислителей в процессе сжигания ракетного и авиационного топлива, а также в производстве красителей и пигментов.
Азотная кислота: основные характеристики
Азотная кислота (гидратированная, раствор с диммиеламином или в нерастворенном виде) - химическое соединение, обладающее сильными окисляющими свойствами. Она является бесцветной или слегка желтоватой жидкостью с характерным запахом.
Азотная кислота хорошо растворима в воде и спирте, а также в органических растворителях. Она обладает кислотными свойствами и может образовывать соли - нитраты, которые также имеют значительное окислительное действие.
Главное применение азотной кислоты связано с ее использованием в производстве различных химических соединений, включая пестициды, взрывчатые вещества, удобрения и красители. Она также используется в лаборатории как реактив и в промышленности в качестве нитрирующего агента.
Однако следует быть особенно осторожными при обращении с азотной кислотой, так как она является токсичным и едким веществом. При попадании на кожу или в глаза она может вызвать ожоги. Поэтому необходимо соблюдать соответствующие меры предосторожности при работе с этим веществом.
Металлы: свойства и особенности

Металлы - это класс химических элементов, обладающих рядом уникальных свойств и особенностей. Одной из характеристик металлов является их способность проводить тепло и электричество. Это объясняется наличием свободных электронов, которые легко передают энергию. Благодаря этому свойству, металлы широко применяются в электротехнике и промышленности.
Еще одной особенностью металлов является их высокая пластичность и формоватость. Они легко поддаются деформации и способны принимать разнообразные формы - от тончайших проводов до массивных конструкций. Это свойство позволяет использовать металлы в процессе производства различных изделий и строительства.
Одним из важных свойств металлов является их стойкость к окислению и коррозии. Многие металлы обладают защитной оксидной пленкой, которая предотвращает контакт металла с воздухом и водой. Это делает металлы долговечными и прочными, что способствует их широкому применению в производстве множества изделий и конструкций.
Важным свойством металлов является их возможность соединяться с другими элементами, образуя сплавы. Сплавы обладают улучшенными свойствами, такими как повышенная прочность, твердость и устойчивость к воздействию различных факторов. Благодаря этому свойству, металлы находят широкое применение в различных отраслях промышленности, включая машиностроение, авиацию и медицину.
Таким образом, металлы обладают рядом уникальных свойств и особенностей, которые делают их незаменимыми материалами в различных сферах деятельности человека. Их высокая проводимость, пластичность и стойкость к коррозии позволяют создавать разнообразные изделия, конструкции и устройства, обеспечивая прочность и эффективность в использовании.
Соединение азотной кислоты с металлами

Азотная кислота – одна из самых распространенных нитратных кислот, химическая формула которой HNO3. Она является сильным окислителем и органическим взрывчатым веществом. Соединение азотной кислоты с металлами может привести к образованию нитратов металлов, которые обладают различными свойствами и имеют широкое применение в различных отраслях промышленности.
- Нитраты аммония – одни из наиболее распространенных нитратов металлов. Они используются в производстве удобрений, взрывчатых веществ, пищевых добавок и в других отраслях промышленности.
- Нитраты щелочных металлов (например, нитрат натрия и нитрат калия) применяются в производстве стекла, пищевой промышленности, медицине и других областях. Они обладают высокой растворимостью в воде и могут быть использованы в качестве удобрений.
- Нитраты тяжелых металлов (например, нитрат свинца и нитрат меди) могут использоваться в производстве красителей, пигментов, взрывчатых веществ, а также в электрохимии и других отраслях промышленности.
Соединение азотной кислоты с металлами может происходить различными способами, например, при растворении металла в кислоте или при пропускании кислоты через металлическую пленку. Реакция между азотной кислотой и металлами может протекать с выделением газа и тепла. При этом могут образовываться осадки, которые могут быть использованы в различных технологических процессах. Нитраты металлов обладают различными свойствами и могут иметь различное применение в различных отраслях промышленности.
Реакция азотной кислоты с металлами

Азотная кислота (HNO3) — сильная кислота, которая реагирует с металлами, образуя нитраты металлов. Реакция азотной кислоты с металлами проходит по следующей схеме: металл + HNO3 → нитрат металла + высвобождение газа.
Реакция между азотной кислотой и металлами является экзотермической и часто сопровождается выделением тепла и образованием пены. Это происходит из-за быстрого выделения оксидов азота, таких как NO2 и NO, которые обеспечивают характерный красно-коричневый цвет раствора около металла.
Реакция азотной кислоты с металлами имеет практическое применение. Например, азотные кислоты используются в химической промышленности для очистки и отжига поверхности металлов перед их покрытием или пайкой. Кислотная обработка продуцирует слой оксида на поверхности металла, который обеспечивает лучшую адгезию покрытий или паяных соединений.
Некоторые металлы, такие как алюминий и цинк, могут реагировать с азотной кислотой только при наличии катализатора, такого как медь. Это связано с поверхностным защитным слоем оксида, который образуется на металле и препятствует дальнейшей реакции. Каталитическое влияние меди облегчает разрушение оксидной пленки и начало реакции.
Получение и свойства соединений

Азотная кислота (HNO3) является одним из наиболее распространенных оксидов азота и обладает высокой реакционной способностью. Она может образовывать различные соединения с металлами, которые обладают разнообразными свойствами и находят широкое применение в различных отраслях промышленности и научных исследованиях.
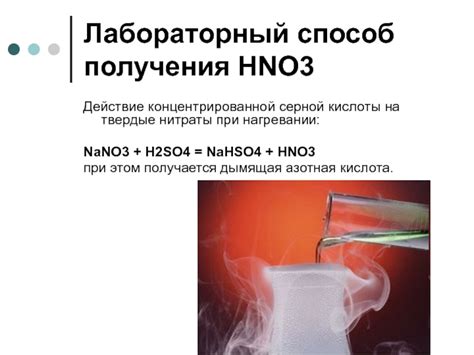
Получение соединений азотной кислоты с металлами осуществляется путем взаимодействия азотной кислоты с металлическими порошками или металлическими ионообменными смолами. Реакция происходит с выделением газообразного оксида азота (NO) и образованием нитратов или нитритов металлов.
Соединения азотной кислоты с металлами обладают рядом химических и физических свойств. Они часто являются кислыми солями и обладают высокой растворимостью в воде. Большинство соединений обладает ярко-выраженными окрасками, которые используются для определения их присутствия и концентрации в реакциях и анализе.
Соединения азотной кислоты с металлами находят широкое применение в различных областях. Например, некоторые соединения используются в производстве взрывчатых веществ, таких как торпеды и фейерверки. Другие соединения используются в производстве удобрений для растений, так как азотная кислота является одним из главных источников азота для растительного роста.
В заключение, соединения азотной кислоты с металлами являются важными веществами, которые обладают высокой реакционной способностью и широким спектром применения. Исследование и использование этих соединений играют важную роль в различных областях науки и промышленности.
Применение соединений азотной кислоты с металлами

Соединения азотной кислоты с металлами находят широкое применение в различных отраслях промышленности и научных исследованиях. Благодаря своим физическим и химическим свойствам, эти соединения играют важную роль в процессах производства и разработке различных материалов.
Одним из основных применений соединений азотной кислоты с металлами является использование их в качестве окислителей. Эти соединения обладают способностью передавать кислородные атомы, что позволяет им служить мощными окислителями в процессах синтеза органических и неорганических соединений.
Соединения азотной кислоты с металлами также используются в процессе нитрирования, при котором к атомам металлов добавляются нитрогруппы. Этот процесс позволяет изменить строение и свойства материала, что находит применение в производстве специальных сплавов, катализаторов и других функциональных материалов.
Окисление металлов соединениями азотной кислоты также используется в процессах гальванизации и электрохимического осаждения. В результате этого процесса металлы покрываются плотной и прочной защитной пленкой, обеспечивая им повышенную коррозионную стойкость и улучшенные электрофизические свойства.
Кроме того, соединения азотной кислоты с металлами применяются в качестве катализаторов в химической промышленности. Они способны активировать реакции, ускорять их ход и повышать выход продукта. Такое использование этих соединений позволяет существенно экономить время и энергию при производстве различных химических веществ.
Использование в промышленности

Азотная кислота, в силу своих химических свойств, находит широкое применение в различных отраслях промышленности. Она используется в процессе производства различных химических соединений, включая удобрения, взрывчатые вещества и пластмассы. Благодаря своей силе, азотная кислота может использоваться для обработки металлов и очистки поверхностей от ржавчины и загрязнений.
В процессе производства взрывчатых веществ, азотная кислота применяется для получения нитроэстров, которые широко используются в производстве взрывчатых веществ, таких как тротил и динамит. Эти вещества находят применение в различных отраслях, включая горнодобывающую промышленность и строительство.
Азотная кислота также используется в процессе производства удобрений. Она является основным источником азота, который является необходимым элементом для роста растений. Удобрения, содержащие азотные соединения, повышают плодородие почвы и способствуют увеличению урожайности сельскохозяйственных культур.
Кроме того, азотная кислота применяется в процессе обработки металлов. Она способна растворять оксиды и загрязнения на поверхности металлов, позволяя достичь высокой степени очистки. Это особенно важно при производстве изделий, требующих высокой степени чистоты, например при производстве электронных компонентов.
Применение в научных исследованиях

Азотная кислота является важным химическим соединением, которое находит широкое применение в научных исследованиях. Одним из основных направлений, где используется азотная кислота, является исследование процессов окисления и реакций соединений с металлами.
Азотная кислота может использоваться для выявления и анализа присутствия металлов в различных материалах. Например, она может быть использована для определения содержания металлических примесей в образцах по их окислительной реакции с кислотой.
Также азотная кислота применяется в научных исследованиях для изучения химических свойств металлов и их взаимодействия с другими веществами. Она может быть использована для получения новых соединений металлов, которые могут иметь интересные свойства и находить применение в различных сферах науки и промышленности.
Другим важным использованием азотной кислоты в научных исследованиях является ее применение в качестве оксидирующего агента. Она может быть использована для окисления различных органических веществ, что позволяет исследовать их реакционную способность и получать новые соединения.
Таким образом, азотная кислота находит широкое применение в научных исследованиях, играя важную роль в изучении металлов и исследовании их химических свойств. Ее использование позволяет расширить наши знания о веществах и открывает новые возможности для развития научных открытий и технологий.
Влияние на окружающую среду

Соединение азотной кислоты с металлами может иметь серьезное влияние на окружающую среду. Оно способно вызывать загрязнение водных ресурсов, поскольку азотные соединения, попадая в воду, могут привести к образованию водорослей и других водных растений, что приведет к снижению концентрации кислорода и возможной гибели рыб и других водных организмов.
Кроме того, соединения азотной кислоты с металлами могут вызывать загрязнение почвы. При попадании на почву, эти соединения могут изменить ее химические свойства и уровень кислотности. Это может негативно отразиться на росте и развитии растений, а также на обитателях почвы, таких как насекомые и микроорганизмы.
Еще одним негативным влиянием соединения азотной кислоты с металлами на окружающую среду является создание смога. Азотные соединения могут приводить к образованию атмосферного аэрозоля, который может вступать в реакцию с другими загрязняющими веществами и образовывать смог. Смог может иметь серьезные последствия для здоровья людей и животных, а также негативно влиять на качество воздуха и климат.
Вопрос-ответ

Какое соединение получается при реакции азотной кислоты с металлом?
При реакции азотной кислоты с металлом образуется соединение, называемое нитратом металла. Это ионные соединения, состоящие из положительно заряженного иона металла и отрицательно заряженного иона нитрата.
Какие свойства имеют соединения азотной кислоты с металлами?
Соединения азотной кислоты с металлами обладают рядом свойств. Во-первых, они обычно растворимы в воде, что позволяет использовать их для приготовления растворов. Во-вторых, они обладают хорошей электропроводностью, что делает их полезными для применения в электротехнике. Кроме того, некоторые соединения азотной кислоты с металлами обладают окраской, что позволяет использовать их в производстве красителей и красок.
