Азотная кислота, или карбонил, является одним из наиболее распространенных неорганических соединений, которые встречаются в природе и широко используются в промышленности. Ее химическая формула HNO3 указывает на то, что она состоит из одного атома водорода (H), одного атома азота (N) и трех атомов кислорода (O).
Реакция азотной кислоты с металлами является одной из наиболее изучаемых областей химии. В результате таких реакций образуются нитраты, соединения, которые имеют важное значение для сельского хозяйства и промышленности. Например, нитраты аммония и калия широко применяются в качестве удобрений, тогда как нитраты бария и стронция используются в производстве пиротехнических смесей и фотоэлементов.
Однако реакция азотной кислоты с металлами может быть опасной и даже взрывоопасной. Это связано с тем, что азотная кислота является сильным окислителем и способна отбирать электроны у металла. В результате металл может гореть с ярким пламенем или даже взорваться при взаимодействии с азотной кислотой. Поэтому при работе с азотной кислотой и металлами необходимо соблюдать все необходимые меры предосторожности и работать в специально оборудованных площадках.
Взаимодействие азотной кислоты с металлами

Азотная кислота (HNO3) является сильным окислителем и сильной кислотой, которая способна реагировать с многими металлами. Взаимодействие азотной кислоты с металлами имеет свои особенности и важные аспекты, которые стоит учитывать.
При контакте азотной кислоты с металлами происходит реакция, в результате которой обычно образуются азотные оксиды и соли азотной кислоты. Реактивность и скорость реакции зависят от различных факторов, включая концентрацию кислоты, температуру и химические свойства металла.
Одной из важных особенностей взаимодействия азотной кислоты с металлами является возможность коррозии металлических поверхностей. Азотная кислота может атаковать металлы, вызывая их разрушение и образование пузырьков газа. Поэтому при работе с азотной кислотой следует соблюдать особую осторожность и меры предосторожности, чтобы избежать проблем с оборудованием и безопасностью.
Особенности реакции азотной кислоты с металлами связаны с тем, что кислота может действовать как окислитель и как кислотное вещество одновременно. В результате этой реакции металлы могут окисляться и образовывать ионы металла с более высокой степенью окисления. Это может приводить к изменению их физических и химических свойств.
Также следует отметить, что взаимодействие азотной кислоты с некоторыми металлами может быть взрывоопасным. Например, азотная кислота сильно реагирует с медью, цинком и алюминием, что может привести к возгоранию или даже взрыву. Поэтому необходимо соблюдать осторожность при работе с этими металлами и азотной кислотой.
Химические свойства азотной кислоты и их влияние на реакцию

Азотная кислота (HNO3) - одно из самых известных и широко используемых неорганических соединений. Она обладает рядом уникальных химических свойств, которые играют важную роль в реакциях с металлами.
Во-первых, азотная кислота является одним из самых сильных окислителей. Она способна окислить металлы, отдавая им свои атомы кислорода. Это позволяет ей образовывать соединения с металлами, такие как азотаты. При этом металлы могут проявлять различные степени активности в реакции с азотной кислотой.
Во-вторых, азотная кислота обладает высокой реакционной способностью. Она может взаимодействовать с металлами при обычных условиях температуры и давления. Это делает ее удобным и универсальным реагентом для проведения различных химических реакций, включая синтез азотатов металлов.
Кроме того, азотная кислота обладает способностью образовывать водородные связи с металлами. Это может привести к образованию координационных соединений, где металл играет роль донора электронной пары, а азотная кислота - акцептора.
Благодаря своим химическим свойствам, азотная кислота находит широкое применение в различных областях, включая промышленность, науку и медицину. Она используется, например, для получения различных соединений азота, для очистки металлических поверхностей от оксидных пленок, а также в качестве катализатора в некоторых реакциях.
Факторы, влияющие на скорость и интенсивность реакции

Реакция азотной кислоты с металлами зависит от нескольких факторов, которые могут повлиять на её скорость и интенсивность. Один из основных факторов - химическая активность металла. Более активные металлы, такие как натрий или калий, реагируют намного быстрее с азотной кислотой по сравнению с менее активными металлами. Это связано с более высокой электроотрицательностью таких металлов, что позволяет им легче отдавать электроны и взаимодействовать с кислотой.
Температура также оказывает влияние на скорость реакции. При повышении температуры молекулы металла и азотной кислоты обладают большей энергией и более интенсивно сталкиваются, что ускоряет химическую реакцию. В результате, реакция может протекать быстрее и более интенсивно.
Концентрация азотной кислоты также влияет на скорость и интенсивность реакции. При повышении концентрации кислоты, количество молекул, способных взаимодействовать с металлом, увеличивается. Это приводит к большему количеству возможных столкновений и, соответственно, к более быстрой и интенсивной реакции.
Наличие катализатора также может повлиять на скорость реакции азотной кислоты с металлами. Катализаторы обычно ускоряют реакцию, обеспечивая альтернативные пути прохождения реакционного цикла. В результате, реакция может протекать быстрее и интенсивнее.
Образование нитратов и их значение в промышленности
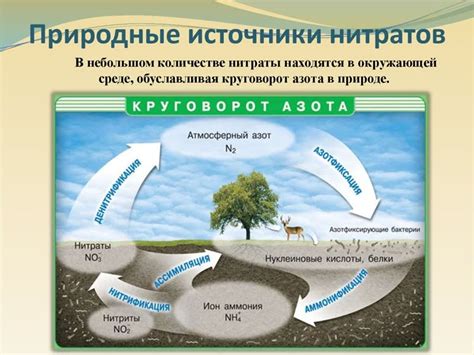
Реакция азотной кислоты с металлами приводит к образованию нитратов. Нитраты являются солью азотной кислоты и широко используются в промышленности. Соли азотной кислоты представляют собой сильные окислители и могут быть использованы в процессах, требующих окисления или реакции с другими веществами.
Образование нитратов имеет большое значение в производстве удобрений. Нитраты аммония, нитраты калия и нитрат аммония с кальцием являются основными компонентами азотных удобрений. Эти удобрения могут быть использованы для повышения плодородия почвы и увеличения урожайности растений.
Нитраты также используются в процессе производства взрывчатых веществ. Нитроглицерин, три нитрата глицерина, широко используется как основной компонент взрывчатых веществ и в промышленности и в военных целях. Нитраты также используются в процессе производства взрывчатых порошков и других взрывчатых композиций.
Еще одно важное применение нитратов - использование их в процессе производства стекла. Некоторые нитраты, такие как нитраты калия и натрия, используются для изменения химических и физических свойств стекла, таких как прозрачность, цвет и термическая стабильность. Эти свойства делают нитраты незаменимыми компонентами для производства стеклянных изделий.
Таким образом, образование нитратов при реакции азотной кислоты с металлами играет важную роль в промышленности. Нитраты находят применение в производстве удобрений, взрывчатых веществ и стекла, что делает их неотъемлемыми компонентами во многих процессах и продуктах.
Роль азотной кислоты в окислительных реакциях с металлами

Азотная кислота (HNO3) играет важную роль в окислительных реакциях с металлами и широко используется в различных химических процессах. Ее характеристической особенностью является ее сильная окислительная способность.
Когда азотная кислота вступает в реакцию с металлами, происходит окисление металла, при этом азотная кислота сама восстанавливается. Это происходит благодаря высокой концентрации кислорода и атомов азота в молекуле HNO3.
Результатом такой реакции может быть образование оксидов металлов и оксидов азота. Например, при взаимодействии азотной кислоты с железом образуется азотисто-железистый(III) оксид (Fe2O3) и оксид азота (NO).
Оксиды металлов, образующиеся в результате реакции металла с азотной кислотой, обычно обладают высокими окислительными свойствами и могут использоваться в качестве катализаторов, а также в производстве различных химических соединений.
Таким образом, окислительные реакции азотной кислоты с металлами являются важными в химическом производстве и науке. Они позволяют получать новые соединения и материалы с уникальными свойствами, а также использовать азотную кислоту в процессах синтеза и каталитической активности.
Важные аспекты безопасного обращения с азотной кислотой

1.Хранение азотной кислоты
Азотная кислота является опасным веществом, поэтому ее следует хранить в специальных контейнерах, которые должны быть плотно закрыты и сохраняться в прохладном и хорошо проветриваемом месте. Необходимо избегать хранения азотной кислоты рядом с органическими и горючими веществами, чтобы предотвратить возможность их взаимодействия.
2.Обращение с азотной кислотой в работе
При работе с азотной кислотой следует соблюдать все меры предосторожности. Рекомендуется надевать перчатки, защитные очки и халат, чтобы защитить кожу и глаза от возможного контакта с кислотой. Также важно работать только в хорошо проветриваемом помещении или под вытяжкой, чтобы избежать ингаляции паров азотной кислоты.
3.Дозирование и разведение азотной кислоты
При работе с азотной кислотой необходимо следить за правильным дозированием и разведением. Рекомендуется использовать градуированную стеклянную посуду и точно соблюдать указанные пропорции. При разведении азотной кислоты всегда добавляйте кислоту к воде, а не наоборот, чтобы избежать возможного высвобождения тепла и брызг.
4.Нейтрализация и утилизация отходов
Важным аспектом обращения с азотной кислотой является правильная нейтрализация и утилизация отходов. После работы с кислотой, остатки необходимо собирать в специальные контейнеры, предназначенные для опасных веществ. Перед утилизацией необходимо провести нейтрализацию отходов по безопасным технологиям или обратиться к специализированным организациям для утилизации.
5.Обучение и информирование сотрудников
Для безопасного обращения с азотной кислотой необходимо обучение и информирование сотрудников. Персонал должен быть ознакомлен с правилами работы с азотной кислотой, использованием средств индивидуальной защиты, процедурами нейтрализации и утилизации отходов. Регулярные инструктажи и обновление знаний обеспечат безопасное обращение с азотной кислотой в рабочей среде.
Вопрос-ответ

Как происходит реакция азотной кислоты с металлами?
Реакция азотной кислоты с металлами протекает в несколько стадий. Сначала происходит диссоциация кислоты, т.е. разделение на ионы H+ и NO3-. Затем ионы H+ реагируют с поверхностью металла, образуя водородный газ и соли металла. В зависимости от конкретного металла, скорость реакции и характер образующихся продуктов могут различаться.
Какие металлы реагируют с азотной кислотой?
Реакция металлов с азотной кислотой возможна только у тех металлов, которые находятся в высокой активности в ряду активности металлов. К таким металлам относятся, например, магний, цинк, железо и алюминий. При этом, каждый металл реагирует с азотной кислотой по-разному, так как его активность и химические свойства различаются.
Какова роль азотной кислоты в реакции с металлами?
Азотная кислота играет роль окислителя в реакции с металлами. Она предоставляет ионы H+ для реакции с поверхностью металла, что позволяет металлу окислиться, образуя водородный газ и соответствующие соли металла. Азотная кислота также может образовывать нитраты металла, которые могут быть использованы в различных химических процессах и промышленности.
Какие предосторожности следует соблюдать при работе с азотной кислотой и металлами?
Работа с азотной кислотой и металлами требует соблюдения определенных предосторожностей. При обращении с азотной кислотой необходимо носить защитные очки и перчатки, чтобы предотвратить контакт с кислотой и ее брызгами. Также необходимо работать в хорошо проветриваемых помещениях или под вытяжным шкафом, чтобы избежать вдыхания паров кислоты. При реакции с металлами следует быть осторожным с парами водорода, которые могут быть взрывоопасными. В целом, следует соблюдать все меры безопасности, указанные в инструкциях и руководствах по работе с химическими веществами.
