Амфотерные металлы - это особый класс элементов, которые могут реагировать как со щелочами, так и с кислотами. Реакция амфотерных металлов со щелочью отличается от обычной реакции металлов с кислотами. В ходе этой реакции амфотерный металл проявляет свою способность поведения как металл, так и неметалл, взаимодействуя с щелочью по особому механизму.
Механизм реакции амфотерных металлов со щелочью заключается в участии взаимодействия основного атома металла и отрицательного иона гидроксида. При этом образуется соединение, которое содержит катион металла и анион гидроксида. Данное соединение может иметь как кислотные, так и основные свойства, в зависимости от условий.
Одним из примеров реакции амфотерного металла со щелочью является взаимодействие алюминия и гидроксида натрия. При этом образуется гидроксид алюминия Al(OH)3, который обладает как основными, так и кислотными свойствами. В кислой среде гидроксид алюминия реагирует с водородными ионами, действуя как основание. В щелочной среде он выступает в роли кислоты, взаимодействуя с гидроксидными ионами.
Реакция амфотерных металлов со щелочью - это интересный физико-химический процесс, который свидетельствует о многогранности свойств амфотерных металлов и позволяет получать разнообразные соединения с использованием щелочей как реагента. Это явление имеет значительное практическое применение и является объектом интереса для исследования в химии.
Амфотерные металлы: свойства и реакции

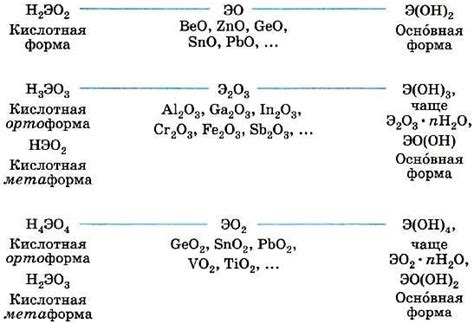
Амфотерные металлы - это металлические элементы, которые могут проявлять свойства как щелочных металлов, так и кислотных оксидов. Такое поведение объясняется наличием у них ионов, способных как отдавать, так и принимать электроны.
Амфотерные металлы реагируют с щелочами, образуя соли и выделяя водород. Например, алюминий (Al) при взаимодействии с гидроксидом натрия (NaOH) образует соль - алюминат натрия (Na[Al(OH)₄]).
Вместе с тем, амфотерные металлы могут реагировать и с кислотами. Так, алюминий взаимодействует с соляной кислотой (HCl), образуя хлорид алюминия (AlCl₃) и выделяя молекулу воды (H₂O).
Интересное свойство амфотерных металлов заключается в том, что их способность проявлять кислотные или щелочные свойства зависит от условий. Например, оксид алюминия (Al₂O₃) взаимодействует с щелочью, образуя гидроксид алюминия (Al(OH)₃), а с кислотой - алюминийсодержащую соль.
Что такое амфотерные металлы?
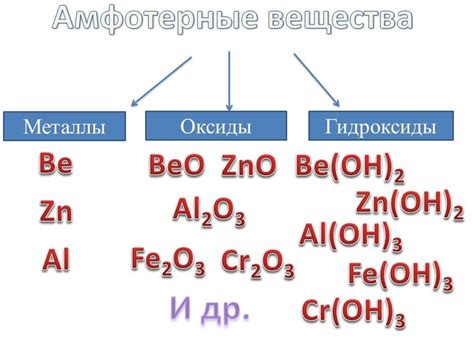
Амфотерные металлы - это группа химических элементов, которые могут образовывать реакции как с кислотами, так и с щелочами. Они обладают возможностью проявлять себя в качестве кислот и оснований, в зависимости от своего окружения. Термин "амфотерный" происходит от греческого слова "amphoteros", что означает "оба". Он указывает на универсальность и гибкость поведения этих элементов.
Амфотерные металлы обладают способностью образовывать соединения с кислотами, выступая в роли оснований. При этом они принимают электроны от протона водорода и образуют положительные ионы. С другой стороны, эти металлы также способны образовывать соединения с щелочами, выступая в роли кислот. В этом случае они отдают электроны, формируя отрицательные ионы.
Примерами амфотерных металлов являются алюминий (Al), цинк (Zn), железо (Fe), медь (Cu) и свинец (Pb). Они могут взаимодействовать как с щелочами, так и с кислотами, образуя различные соединения. Например, алюминий может реагировать с щелочами и кислотами, образуя алюминий гидроксид [Al(OH)3] и алюминий сульфат [Al2(SO4)3], соответственно.
Механизм реакции амфотерного металла со щелочью
Реакция амфотерного металла со щелочью является сложным процессом, который включает взаимодействие ионов металла и ионов гидроксида в щелочном растворе. Данный механизм проявляется в различных соединениях, например, в реакции алюминия с гидроксидом натрия.
На начальном этапе реакции ионы гидроксида разделяются на положительные и отрицательные частицы. Положительные ионы притягиваются к отрицательным частям металла, образуя комплексы. Данное взаимодействие происходит благодаря образованию водородных связей между ионами.
Далее происходит перемещение электронов в системе, что приводит к образованию исходного соединения с более высокой степенью окисления металла. Этот этап реакции называют окислительной фазой.
Последующая фаза реакции - восстановительная, в которой ионы гидроксида меняются на молекулы воды и электроны возвращаются к амфотерному металлу, позволяя ему принять более низкую степень окисления и образовать соединение с щелочью.
Механизм реакции амфотерного металла со щелочью может быть представлен в виде таблицы:
| Амфотерный металл | Щелочь | Результат реакции |
|---|---|---|
| Алюминий | Гидроксид натрия | Алюминат натрия и вода |
| Цинк | Гидроксид калия | Цинкат калия и вода |
| Свинец | Гидроксид кальция | Свинцоватокальций и вода |
Таким образом, механизм реакции амфотерного металла со щелочью заключается в образовании комплексов с ионами гидроксида, переносе электронов и образовании новых соединений между металлом и щелочью.
Примеры реакций амфотерных металлов с щелочью
1. Алюминий: Амфотерный металл алюминий реагирует и с кислотами, и с щелочами. С щелочами алюминий образует гидроксид алюминия (Al(OH)3), который обладает амфотерными свойствами и легко растворяется в щелочах. Например, если добавить алюминий к раствору натрия гидроксида (NaOH), произойдет реакция, при которой образуется растворимая соль натрия алюмината (Na[Al(OH)4]), а также выделяется водородный газ (H2).
2. Цинк: Цинк также является амфотерным металлом и способен реагировать с щелочами. Например, растворение цинка в растворе натрия гидроксида приводит к образованию гидроксида цинка (Zn(OH)2). Гидроксид цинка нерастворим в воде, но растворяется в щелочах, образуя комплексные ионы с анионом гидроксида.
3. Тинк: Тинк также является амфотерным металлом и проявляет реакцию с щелочами. При растворении тинка в растворе натрия гидроксида образуется гидроксид тинка (Sn(OH)2), который в присутствии щелочей превращается в соли гидроксокомплексов с гидроксидными ионами.
Таким образом, амфотерные металлы, такие как алюминий, цинк и тинк, демонстрируют свою способность реагировать с щелочами, образуя соответствующие гидроксиды, которые могут дальше растворяться в щелочных средах.
Роль pH в реакции амфотерного металла со щелочью

Реакция амфотерного металла со щелочью зависит от значения pH раствора. pH – это мера кислотности или щелочности раствора, которая характеризует концентрацию ионов водорода в растворе. Она может быть от 0 до 14, где значения от 0 до 7 соответствуют кислому раствору, 7 – нейтральному, а от 7 до 14 – щелочному.
При нейтральном pH амфотерный металл не проявляет особой реактивности и не происходит образование осадка или растворение вещества, так как его поведение в данном случае подобно реакции с водой. Однако, при изменении pH раствора в кислую или щелочную сторону, происходят различные химические реакции с участием амфотерного металла.
В кислом растворе амфотерный металл может выступать в качестве основания, при этом он реагирует с избытком ионов водорода, образуя соль и воду. Например, реакция алюминия с кислотой хлороводородной:
- Al + HCl → AlCl3 + H2
В щелочном растворе амфотерный металл может выступать в качестве кислоты, реагируя с ионами гидроксида. Образуется соль и вода. Например, реакция алюминия с гидроксидом натрия:
- Al + NaOH + H2O → Na[Al(OH)4]
Таким образом, значение pH раствора играет важную роль в реакции амфотерного металла со щелочью, определяя его поведение и химическую реакцию с окружающими веществами.
Химические свойства амфотерных металлов
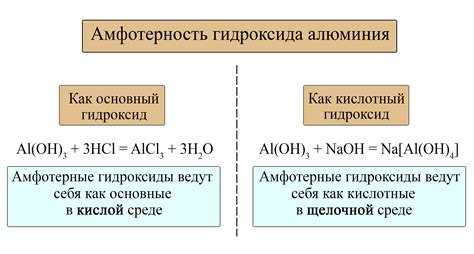
Амфотерные металлы - это металлы, которые могут проявлять как кислотные, так и основные свойства в растворах. Такое поведение обусловлено наличием у них свободных электронных пар и способностью образовывать различные ионы в растворах.
Реакция амфотерного металла со щелочью происходит в две стадии. На первой стадии металл образует ион металла с положительным зарядом, отдавая электроны. Далее, на второй стадии, образовавшийся ион металла соединяется с гидроксид-ионом из раствора щелочи, образуя осадок гидроксида металла.
Примером амфотерного металла является алюминий, который реагирует и с кислотами, и с щелочами. В реакции алюминий вступает во взаимодействие с гидроксид-ионом щелочи, образуя вещество под названием алюминат натрия или калия.
Другим примером амфотерного металла является цинк. Цинк также может реагировать с гидроксидами щелочных металлов, образуя гидроксид цинка. Эта реакция может быть использована для получения соли цинка, которая широко применяется в промышленности и лабораторной практике.
Влияние температуры на реакцию амфотерного металла со щелочью

Температура является одним из факторов, оказывающих влияние на характер и скорость реакции амфотерных металлов со щелочью. Изменение температуры может в значительной мере влиять на химическое взаимодействие между этими веществами.
При повышении температуры реакция амфотерного металла со щелочью может протекать более интенсивно и быстро. Это обусловлено тем, что повышение температуры увеличивает скорость молекулярных движений и тем самым способствует увеличению частоты столкновений между частицами веществ, участвующими в реакции.
С другой стороны, некоторые амфотерные металлы могут образовывать растворимые комплексы с щелочью при повышенных температурах. Например, оксид цинка (ZnO) может реагировать с гидроксидом натрия (NaOH) при нагревании, образуя растворимый комплекс цинкат натрия (Na2ZnO2).
Однако, при очень высоких температурах некоторые амфотерные металлы могут плавиться и образовывать нерастворимые оксиды или гидроксиды. Например, при нагревании оксида алюминия (Al2O3) с щелочью, возможно образование нерастворимого гидроксида алюминия (Al(OH)3) или оксида (Al2O3).
Таким образом, температура играет важную роль в реакции амфотерного металла со щелочью. Она может влиять как на скорость и интенсивность реакции, так и на образование растворимых или нерастворимых соединений.
Применение амфотерных металлов в промышленности и науке
Амфотерные металлы - это элементы, которые могут реагировать как с кислотами, так и с щелочами. Их универсальная природа делает их важными компонентами в промышленности и науке.
Один из примеров применения амфотерных металлов - это производство керамики. Некоторые амфотерные металлы, такие как алюминий и цирконий, обладают высокой термической стойкостью и не подвергаются коррозии. Поэтому они широко используются в процессе изготовления керамических изделий, таких как посуда, изоляционные материалы и детали для промышленных печей.
Другой областью, где амфотерные металлы играют важную роль, является производство электроники. Например, германий, являющийся амфотерным металлом, используется в полупроводниковой промышленности для создания транзисторов и диодов. Эти элементы являются основой большинства современных электронных устройств, включая компьютеры, мобильные телефоны и телевизоры.
Амфотерные металлы также находят применение в области катализа. Отдельные амфотерные металлы, такие как цинк и никель, могут быть использованы в качестве катализаторов для различных химических реакций. Например, они могут способствовать полимеризации или гидрированию органических соединений, а также обеспечивать превращение одного вида сырья в другой с помощью различных катализаторов и реагентов.
Таким образом, амфотерные металлы являются важными и универсальными элементами в промышленности и науке. Их свойства и реактивность позволяют использовать их в широком спектре различных процессов и технологий. Благодаря этому, амфотерные металлы продолжают находить новые области применения и становятся незаменимыми компонентами в различных сферах деятельности.
Вопрос-ответ

Какой механизм реакции амфотерного металла со щелочью?
Реакция амфотерного металла со щелочью происходит с помощью двух стадий: присоединение гидроксидных ионов к поверхности металла и последующая диссоциация образовавшихся гидроксидных комплексов.
Какие примеры можно привести реакций амфотерного металла со щелочью?
Примерами реакций амфотерных металлов со щелочью являются реакция алюминия с натрием, реакция цинка с натрием и реакция свинца с калием.
