Металлы – это широкая группа химических элементов, которые обладают определенными общими свойствами и характеристиками. Они являются отличными проводниками электричества и тепла, обладают высокой пластичностью и прочностью. Кроме того, большинство металлов обладает блеском, так как они отражают свет. В этой статье мы рассмотрим основные реакции и характеристики металлов, которые делают их настолько уникальными и полезными в нашей жизни.
Одним из наиболее известных свойств металлов является их способность вступать в химические реакции. Металлы обычно реагируют с кислотами, образуя соли и выделяя водород. Эта реакция называется коррозией и часто приводит к разрушению металлических конструкций.
Кроме того, металлы способны образовывать сплавы, что делает их еще более полезными. Сплавы – это комбинации двух и более металлов, которые сочетают в себе лучшие свойства каждого из них. Например, сплавы могут быть более прочными или устойчивыми к коррозии, чем отдельные металлы.
Важно отметить, что некоторые металлы обладают радиоактивными свойствами. Они могут излучать радиацию, которая является опасной для живых организмов. К ним относятся такие элементы, как уран, торий и плутоний. Эти металлы используются в ядерной энергетике, однако требуют особой осторожности и контроля, чтобы не вызвать непредсказуемые последствия.
Металлы имеют широкое применение в различных отраслях промышленности и технологий. Они используются в производстве автомобилей, самолетов, строительных материалов и многих других продуктов. Благодаря своим уникальным свойствам, металлы играют важную роль в развитии современного общества и способствуют прогрессу науки и техники.
Физические свойства металлов
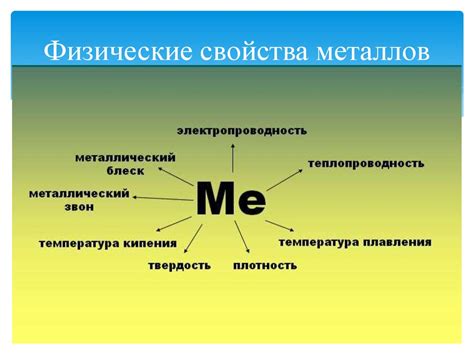
Проводимость – одно из главных физических свойств металлов. Они способны эффективно проводить электрический ток. Это свойство обусловлено свободным движением электронов в металлической решетке.
Теплоемкость – еще одно важное физическое свойство металлов. Металлы обладают высокой теплоемкостью, то есть они способны удерживать большое количество тепла без значительного изменения температуры.
Теплопроводность – характеристика способности материала передавать тепло. Металлы обладают высокой теплопроводностью, что делает их хорошими материалами для производства теплообменных элементов и конструкций.
Плотность – еще одно из физических свойств металлов. Металлы обладают высокой плотностью, что делает их тяжелыми и плотными материалами. Например, золото и платина являются самыми плотными металлами.
Пластичность и проволочность – свойства металлов принимать различные формы под воздействием силы. Металлы могут быть легко раскатаны, прокатаны, вытянуты в проволоку или притерты в пленку. Это делает их идеальными материалами для производства различных изделий и конструкций.
Тугоплавкость – обратное свойство пластичности и проволочности. Металлы обладают высокой температурой плавления, что делает их тугоплавкими материалами. Это позволяет использовать металлы для производства продуктов, которые должны выдерживать высокую температуру, например, котлы или двигатели.
Магнитные свойства – свойство металлов, которое зависит от наличия магнитных доменов в их структуре. Некоторые металлы обладают намагничиваемостью и притягиваются к магниту, в то время как другие металлы являются немагнитными и не притягиваются к магниту.
Химические свойства металлов

Металлы обладают рядом характеристических химических свойств, которые делают их особыми и полезными в различных областях жизни. Рассмотрим некоторые из них.
1. Реакция с кислородом. Многие металлы реагируют с кислородом из воздуха, образуя оксиды. Например, железо ржавеет под действием кислорода, а алюминий покрывается оксидной пленкой, которая защищает его от дальнейшей реакции.
2. Реакция с кислотами. Металлы активно взаимодействуют с кислотами, образуя соли и выделяя водород. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяя водородный газ.
3. Коррозионная устойчивость. Некоторые металлы, такие как золото и платина, характеризуются высокой устойчивостью к коррозии. Благодаря этому они широко используются в ювелирном и электронном производстве.
4. Реакция с водой. Некоторые металлы, например, натрий и калий, реагируют с водой, выделяя водород. Эта реакция сопровождается интенсивным выделением тепла и образованием гидроксида металла.
5. Поверхностная активность. Некоторые металлы, такие как алюминий и калий, обладают поверхностной активностью, то есть способностью реагировать с веществами на своей поверхности. Благодаря этому они используются в катализаторах и других процессах, где требуется активное участие металла в химической реакции.
Это лишь некоторые из химических свойств металлов, которые делают их неотъемлемой составляющей нашей жизни.
Взаимодействие металлов с кислородом

Кислород является одним из основных реагентов в химических реакциях металлов. Многие металлы обладают способностью вступать во взаимодействие с кислородом, образуя оксиды. Эти реакции часто сопровождаются выделением тепла и света.
Взаимодействие металлов с кислородом может происходить при нагреве или при реакции с кислородом воздуха. Металлы могут гореть в кислороде или образовывать оксиды. Некоторые металлы, такие как магний и алюминий, горят с ярким пламенем при контакте с воздухом.
При взаимодействии металлов с кислородом образуются различные оксиды. Например, железо образует оксид железа (FeO), медь - оксид меди (CuO), алюминий - оксид алюминия (Al2O3). Оксиды являются химически стабильными соединениями, обычно имеющими характерную цветность.
Реакция металлов с кислородом является важным процессом, который может приводить к коррозии металлических поверхностей. Например, железо окисляется воздухом и образует ржавчину, что может привести к потере прочности и долговечности металлических конструкций. Поэтому для защиты металлов от воздействия кислорода часто применяют различные защитные покрытия или специальные антикоррозийные составы.
Реакции металлов с кислотами

Металлы являются активными веществами и могут реагировать с кислотами, образуя соли и выделяя водород. Эти реакции являются химическими процессами, которые можно описать уравнениями.
В зависимости от свойств металла и кислоты, реакция может протекать по-разному. Некоторые металлы очень активны и реагируют с кислотами с выделением большого количества водорода. Например, натрий реагирует с соляной кислотой:
2Na + 2HCl → 2NaCl + H2
Другие металлы меньше активны и реагируют с кислотами медленнее. Например, железо реагирует с серной кислотой:
Fe + H2SO4 → FeSO4 + H2
Изучение реакций металлов с кислотами позволяет определить их активность и реакционную способность. Также эти реакции широко применяются в промышленности и лабораторных исследованиях.
Для удобства и систематизации реакций металлов с кислотами, их можно представить в виде таблицы:
| Металл | Кислота | Соль | Водород |
|---|---|---|---|
| Натрий (Na) | Соляная кислота (HCl) | ClNa | H2 |
| Железо (Fe) | Серная кислота (H2SO4) | FeSO4 | H2 |
Такая таблица позволяет сравнивать свойства и характеристики различных металлов при их взаимодействии с кислотами.
Электрохимические свойства металлов
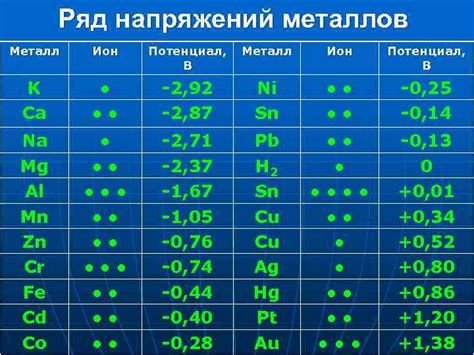
Электрохимические свойства металлов определяют их способность вступать в реакции с окружающими их веществами, обусловленные передачей электронов. Эти свойства играют важную роль во многих процессах, таких как электрохимическая коррозия, синтез и хранение энергии.
Металлы проявляют различную активность в электрохимических реакциях, что связано с их электрохимическим потенциалом. Электрохимический потенциал металла характеризует его способность отдавать или принимать электроны и, следовательно, участвовать в окислительно-восстановительных реакциях.
На основании электрохимического потенциала металлы можно разделить на активные и пассивные. Активные металлы, такие как натрий или калий, обладают высокой активностью и легко окисляются, образуя ионы в растворе. Пассивные металлы, например, золото или платина, имеют низкую активность и образуют плотную оксидную пленку на поверхности, защищающую их от дальнейшей коррозии.
Электрохимические свойства металлов также определяют возможность проведения электрического тока. Металлы, обладающие высокой электропроводностью, называются проводниками. Они хорошо передают электроны благодаря свободным электронам в их структуре. Кроме того, некоторые металлы обладают способностью к адсорбции электролитов на своей поверхности, что позволяет использовать их в электрохимических процессах, таких как электролиз или электрохимические синтезы.
Вопрос-ответ

Что такое общие свойства металлов?
Общие свойства металлов — это характеристики, которые присущи большинству металлов. К ним относятся высокая тепло- и электропроводность, блеск, пластичность, деформируемость, металлический блеск и т.д. Эти свойства связаны с особенностями строения и химической природы металлов.
Какая роль играет реакция металлов с окислителями в их химических свойствах?
Реакция металлов с окислителями — это одно из основных свойств металлов. Металлы имеют свободные электроны в валентной зоне, которые могут легко передаваться окислителю. В результате такой реакции образуется соединение металла с окислителем (оксид), а металл сам переходит в ионное состояние. Это позволяет металлам быть активными в химических реакциях и играть важную роль в различных процессах, таких как коррозия, синтез химических соединений и др.
