Металлы - это элементы, которые обладают хорошей проводимостью электричества и тепла. Они играют важную роль в нашей жизни, используются в различных отраслях промышленности и научных исследованиях. Взаимодействие металлов с простыми веществами, такими как кислород, вода, кислоты и щелочи, является одним из ключевых процессов, определяющих их химические свойства и возможности применения.
Взаимодействие металлов с кислородом приводит к образованию оксидов металла. Оксиды могут быть кислотными или щелочными, в зависимости от свойств металла. Например, алюминий взаимодействует с кислородом и образует алюминиевый оксид, который имеет щелочные свойства. Реакция между металлом и кислородом может быть представлена уравнением:
2Al + 3O2 → 2Al2O3
Вода также является важным простым веществом, с которым металлы могут взаимодействовать. Взаимодействие металла с водой может приводить к образованию оксидов металла и выделению водорода. Например, натрий реагирует с водой и образует натриевую щелочь и выделяется водород. Уравнение реакции может быть представлено следующим образом:
2Na + 2H2O → 2NaOH + H2
Кроме того, металлы могут вступать в реакцию с кислотами и щелочами. Реакция металла с кислотой приводит к образованию соли металла и выделению водорода. Например, цинк реагирует с серной кислотой и образует сульфат цинка и выделяется водород:
Zn + H2SO4 → ZnSO4 + H2
Взаимодействие металлов с щелочами также может приводить к образованию солей металла. Например, натрий реагирует с гидроксидом натрия и образует соль натрия и воду:
2Na + 2NaOH → 2Na2O + H2O
Таким образом, взаимодействие металлов с простыми веществами имеет важное значение для понимания их химических свойств и возможных реакций.
Реакция металлов с кислородом

Кислород является одним из самых активных химических элементов, способных участвовать во множестве химических реакций. Взаимодействие кислорода с металлами также представляет собой важный и распространенный процесс.
Реакция металлов с кислородом ведет к образованию металлических оксидов. В зависимости от активности металла и условий реакции, оксиды могут иметь различную степень окисления металла. Например, низкоактивные металлы, такие как медь или серебро, взаимодействуют с кислородом медленно и образуют стабильные оксиды.
Высокоактивные металлы, такие как натрий или калий, имеют большую склонность к реакции с кислородом. При этом образуются более нестабильные оксиды, которые могут легко реагировать с водой или другими соединениями.
Реакция металлов с кислородом является основой процесса коррозии металлов. Когда металл находится в присутствии кислорода и влаги, происходит окисление металла, что приводит к образованию оксидов и порче металлической поверхности.
Следует отметить, что взаимодействие металлов с кислородом может быть контролируемым процессом, который используется для получения определенных металлических соединений. Например, при обжиге железа на воздухе образуется железооксид, который является основным компонентом ржавчины и используется в производстве красок и пигментов.
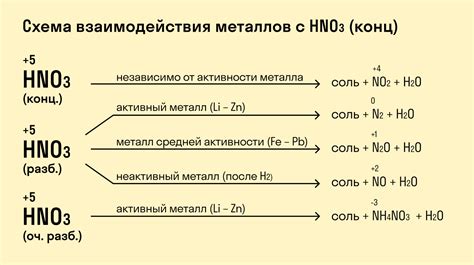
Взаимодействие металлов с неокисными кислотами

Неокисные кислоты - это кислоты, содержащие в своей молекуле присоединенные кислородные атомы. Взаимодействие металлов с неокисными кислотами происходит путем образования ионов металла и ионов кислоты. Такие реакции носят характер окислительно-восстановительных, где металл вступает в реакцию в качестве восстановителя.
Натрий является хорошим примером металла, вступающего во взаимодействие с неокисными кислотами. Кислородные атомы в молекуле кислоты образуют положительно заряженные ионы гидроксония (OH-), которые образуют соль с ионами металла. Например, взаимодействие натрия с серной кислотой приводит к образованию сульфата натрия и выделению воды.
Другим примером является взаимодействие алюминия с соляной кислотой. Кислородные атомы в молекуле кислоты образуют ионы хлора (Cl-), а алюминий образует соль алюминия и высвобождает водород. Здесь алюминий вступает в реакцию как восстановитель, переходя из своего ионного состояния в нейтральное.
Взаимодействие металлов с неокисными кислотами является важным процессом, так как позволяет получать соли металлов, которые имеют широкое применение в различных отраслях промышленности, а также в жизни человека.
Металлическая реакция с нейтральными солями
Металлическая реакция с нейтральными солями представляет собой процесс взаимодействия металла с нейтральной солью, в результате которого образуются новые соединения. Эта реакция является типичным примером химической реакции, происходящей между металлом и солями.
Во время металлической реакции с нейтральными солями металл освобождает свои электроны и образует положительные ионы. В свою очередь, нейтральная соль диссоциирует на положительные ионы металла и отрицательные ионы аниона. Образующиеся положительные ионы металла соединяются с отрицательными ионами аниона, образуя новые растворимые или нерастворимые соединения.
Металлическая реакция с нейтральными солями может протекать по разным механизмам, в зависимости от характера ионов и температуры процесса. Например, реакция может протекать с образованием осадка, когда новое соединение выпадает в твердом состоянии. Или же реакция может быть обратимой, при которой происходит равновесие между реагентами и продуктами.
Металлическая реакция с нейтральными солями имеет широкое применение в различных областях науки и промышленности. Например, данная реакция используется для получения металлических соединений, а также для очистки и обработки поверхностей металлов.
Металлическая реакция с основаниями
Металлическая реакция с основаниями является одним из типов химических реакций, при котором металл вступает во взаимодействие с основанием. Основания - это химические соединения, которые обладают щелочными свойствами и содержат гидроксидные ионы (OH-). В результате этой реакции происходит образование солей и выделение воды.
Реакция металла с основанием может быть представлена уравнением реакции, где металл обозначается символом M, а основание - формулой MOH. Например, реакция металла натрия (Na) с гидроксидом натрия (NaOH) представляется следующим уравнением:
2Na + 2NaOH → 2Na+ + 2OH- + H2
В данном случае металл натрий вступает в реакцию с гидроксидом натрия, образуя ионы натрия(Na+) и гидроксидные ионы(OH-), а также выделяя молекулу воды (H2).
Металлическая реакция с основаниями имеет широкое применение в различных областях науки и техники. Например, она используется в процессе нейтрализации кислот, при производстве солей, в химическом анализе и других областях. Кроме того, эта реакция имеет большое значение в понимании химических процессов и взаимодействия металлов с другими веществами.
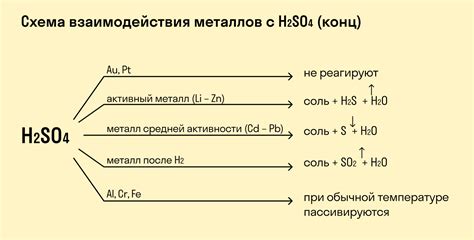
Взаимодействие металлов с галогенами

Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br) и йод (I). Взаимодействие металлов с галогенами происходит при образовании солей металлогалогенидов.
При взаимодействии металлов с галогенами происходят окислительно-восстановительные реакции, в результате которых один элемент окисляется, а другой элемент восстанавливается.
Взаимодействие металлов с галогенами может происходить с разной интенсивностью в зависимости от свойств металла и галогена. Например, металлы активной группы (например, натрий, калий) реагируют сильно с галогенами, высвобождая большое количество энергии и образуя соли металлогалогенидов.
Эти реакции могут проходить с выделением яркого пламени, так как металлогалогениды обладают способностью окрашивать пламя в яркие цвета. Например, хлорид натрия имеет желтый цвет, а бромид калия - красный цвет.
Таким образом, взаимодействие металлов с галогенами является важным процессом в химических реакциях и имеет широкое применение в различных областях науки и техники.
Металлическая реакция с водородом

Металлическая реакция с водородом является одной из наиболее известных и важных химических реакций. Она происходит при контакте металлов с молекулами водорода и может привести к образованию соединений, называемых гидридами.
Во время данной реакции атомы металла вступают в химическую связь с атомами водорода и образуют гидридные ионы. В результате этого процесса меняется химический состав и структура металла. Гидриды металлов часто обладают значительной химической активностью и могут использоваться в различных промышленных и научных процессах.
Некоторые металлы, такие как литий, натрий и калий, реагируют с водородом очень быстро и энергично даже при комнатной температуре. Другие металлы, такие как железо или медь, требуют повышенных температур для начала реакции. Реакции металлов с водородом могут протекать как при нормальных условиях давления и температуры, так и при повышенных давлении или в определенных условиях каталитического воздействия.
В лаборатории реакция металла с водородом может проводиться с помощью специального генератора водорода или добавления кислорода к цинковому порошку, что приводит к выделению водорода. Несмотря на то, что эта реакция является широкоизвестной, она позволяет исследовать особенности химического взаимодействия металлов и водорода, а также применять их в различных областях науки и техники.
Вопрос-ответ

Какие простые вещества могут взаимодействовать с металлами?
Металлы могут взаимодействовать с различными простыми веществами, такими как кислород, сера, фосфор, азот, водород и многими другими.
Какие металлы реагируют с кислородом?
Множество металлов реагируют с кислородом, образуя оксиды. Например, железо реагирует с кислородом и образует оксид железа (Fe2O3), а медь образует оксид меди (CuO).
Что происходит при взаимодействии металлов с серой?
При взаимодействии металлов с серой образуются сульфиды. Например, железо реагирует с серой и образует сульфид железа (FeS).
Какие металлы реагируют с водородом?
Некоторые металлы, такие как натрий и калий, реагируют с водородом, образуя гидриды. Например, натрий реагирует с водородом и образует гидрид натрия (NaH).
Могут ли металлы реагировать с фосфором?
Да, некоторые металлы, например, медь и цинк, реагируют с фосфором, образуя фосфиды. Например, медь реагирует с фосфором и образует фосфид меди (Cu3P).
