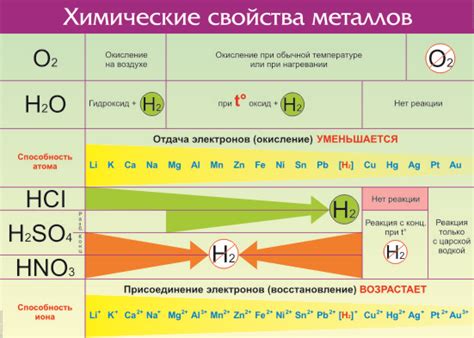
Водород – это один из наиболее широко распространенных элементов в природе, и его химическая активность играет важную роль во многих физико-химических процессах. Один из способов проявления химической активности водорода – это его реакции с оксидами металлов.
Реакции водорода с оксидами металлов являются экзо- и эндотермическими процессами, которые протекают с выделением тепла. В ходе реакции происходит образование соответствующих гидроксидов металлов и выделение воды. Элементарный водород в данных реакциях проявляет себя как восстановитель, обладающий огромной энергией.
Реакции водорода с оксидами металлов могут быть использованы для получения металлов восстановлением оксидов. Они широко применяются в промышленности и лабораторных условиях для получения высокоочищенных металлов. Также эти реакции находят применение в процессах электролиза, при производстве водорода и в различных технологических процессах, требующих редукции металлов.
Свойства водорода

Водород - самый легкий элемент в периодической системе и обладает рядом уникальных свойств. Этот химический элемент легко воспламеняется в воздухе при наличии огня или искры. Взаимодействие водорода с металлами порождает газообразные соединения, такие как гидриды.
Одним из важных свойств водорода является его высокая химическая активность. Водород реагирует с многими веществами, образуя различные соединения. Один из примеров - реакция водорода с оксидами металлов, в результате которой образуются гидроксиды. Это свидетельствует о том, что водород обладает окислительными свойствами.
Кроме того, водород обладает высокой химической стабильностью при низких температурах и давлениях. В нормальных условиях водород существует в виде двухатомных молекул, обозначаемых формулой H2. При повышенных температурах и давлениях водород может образовывать более сложные структуры, такие как металлический водород или водородные кластеры.
Водород также обладает высокой энергетической плотностью, что делает его привлекательным в качестве источника энергии. Использование водорода в топливных элементах и водородных батареях позволяет получать электроэнергию без выброса вредных веществ и углекислого газа.
Химическая активность водорода

Водород является самым легким элементом в таблице Менделеева. Он химически активен и обладает свойствами как металлов, так и неметаллов. Химическая активность водорода проявляется в его способности реагировать с различными веществами.
Реакции водорода с оксидами металлов являются одним из ярких примеров его химической активности. При взаимодействии водорода с оксидами металлов образуется вода и металл. Эта реакция называется реакцией восстановления оксидов металлов.
Примеры таких реакций:
- Водород реагирует с оксидом железа(III), образуя воду и металлическое железо:
- Водород реагирует с оксидом меди, образуя воду и металлическую медь:
Fe2O3 + 3H2 → 2Fe + 3H2O
CuO + H2 → Cu + H2O
Также водород может реагировать с другими оксидами, солями, кислотами и многими другими веществами. Водород играет важную роль во многих химических процессах и имеет широкое применение в промышленности и научных исследованиях.
Оксиды металлов
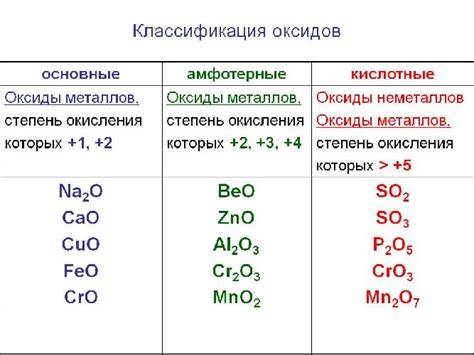
Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Они обладают широким спектром свойств и находят применение в различных областях науки и промышленности.
Оксиды металлов имеют разные степени окисления металла и могут быть как ионными (состоять из положительных и отрицательных ионов), так и молекулярными (состоять из нейтральных молекул).
Эти соединения обычно обладают высоким плавлением и кипением, а также образуют кристаллическую решетку. Они также являются прекрасными носителями электрического тока и тепла.
Важным свойством оксидов металлов является их реакционная способность. Многие из них могут реагировать с водой, кислородом или с другими веществами, что делает их активными соединениями и важными для производства различных химических продуктов.
Некоторые оксиды металлов, такие как оксиды алюминия, железа или меди, находят широкое применение в промышленности, строительстве и электронике. Они используются для производства стали, керамики, стекла, электродов и многих других материалов.
Таким образом, оксиды металлов представляют собой важные и широко используемые химические соединения, обладающие разнообразными свойствами и способностью реагировать с другими веществами.
Реакции водорода с оксидами металлов

Реакции водорода с оксидами металлов подтверждают высокую химическую активность водорода и его способность образовывать соединения с различными элементами. Оксиды металлов являются химически активными соединениями, содержащими кислород, а водород является сильным восстановителем.
В результате реакции водорода с оксидами металлов образуются гидроксиды, которые представляют собой основания. Реакция происходит по следующей схеме: водород вступает во взаимодействие с кислородом оксида металла, образуя воду, а металл восстанавливается.
Например, реакция водорода с оксидом железа Fe2O3 приводит к образованию воды H2O и гидроксида железа Fe(OH)3. В этой реакции водород восстанавливает трехвалентное железо до двухвалентного состояния, а кислород оксида железа переходит в виде воды.
Реакции водорода с оксидами металлов могут протекать как при нагревании, так и при обычных условиях. Эти реакции имеют важное практическое значение, например, в процессе получения чистого водорода или как способ очистки металлов от оксидов.
Активность реакций
Реакции водорода с оксидами металлов подтверждают высокую химическую активность водорода. Водород проявляет себя как сильное восстановительное вещество в реакциях с оксидами металлов. Он способен отдавать электроны и образовывать воду.
Активность реакций водорода с оксидами зависит от различных факторов, таких как концентрация веществ, температура и наличие катализаторов. Чем выше концентрация водорода, тем быстрее протекает реакция. Повышение температуры также обычно способствует увеличению скорости реакции.
Кроме того, некоторые металлы имеют большую активность в реакции с водородом. Например, щелочные металлы, такие как натрий и калий, быстро реагируют с водородом даже при комнатной температуре. В результате реакции образуется гидроксид металла и высвобождается водородный газ.
Таким образом, реакции водорода с оксидами металлов являются ярким примером его химической активности. Водород обладает способностью взаимодействовать с различными соединениями и является важным участником многих реакций в химии.
Подтверждение химической активности
Реакции водорода с оксидами металлов представляют собой яркий пример проявления химической активности водорода. Водород активно взаимодействует с большинством оксидов металлов, изменяя их степень окисления и образуя новые соединения.
В результате реакций оксидов металлов и водорода образуются соответствующие гидроксиды металлов, которые можно обнаружить по образованию осадка. При этом основанием химической реакции является протон, который водород ионизируется в водной среде. Таким образом, реакция водорода с оксидами металлов подтверждает его химическую активность.
Водород является самым легким элементом в периодической системе и относится к амфотерным веществам, что означает его способность проявлять как кислотные, так и основные свойства. Взаимодействие водорода с оксидами металлов происходит в результате обменной реакции, где один из металлов окисляется, а водород восстанавливается.
Реакции водорода с оксидами металлов могут быть иллюстрированы с помощью химических уравнений. Например, реакция между водородом и оксидом натрия будет выглядеть следующим образом:
- Na2O + H2 → NaOH + H2O
В данной реакции натрий переходит из ионной формы в молекулярную, а водород восстанавливает окислительное состояние.
Таким образом, реакции водорода с оксидами металлов не только подтверждают его химическую активность, но и являются основой для получения гидроксидов металлов, которые широко используются в различных областях науки и промышленности.
Значение реакций водорода с оксидами металлов

Реакции водорода с оксидами металлов имеют большое значение и широко применяются в различных областях химии и промышленности. Эти реакции подтверждают высокую химическую активность водорода и его способность к образованию не только ионов, но и молекул.
Реакции водорода с оксидами металлов часто используются в синтезе различных соединений. Например, представители группы І и ІІ, реагируя с водородом, образуют гидриды металлов - соединения, имеющие широкое применение в металлургии, производстве сплавов и водородных топливных элементах.
Кроме того, реакции водорода с оксидами металлов используются в процессе очистки различных материалов. Водород, образуяся при реакции с оксидами металлов, проявляет сильные восстановительные свойства и способен очищать поверхность металлов от загрязнений, окислов и оксидов.
Не менее значимым является применение реакций водорода с оксидами металлов в производстве водорода. Образование водорода при этом процессе является важным этапом в получении этого газа на промышленных масштабах. Кроме того, водород, полученный при реакциях с оксидами металлов, обладает высокой очисткой и может использоваться в различных химических процессах.
Таким образом, реакции водорода с оксидами металлов не только подтверждают его химическую активность, но и находят широкое приложение в различных областях науки и промышленности. Эти реакции играют важную роль в синтезе соединений, очистке материалов и получении водорода, что делает их неотъемлемой частью химических процессов.
Вопрос-ответ

Какое значение имеет реакция водорода с оксидами металлов?
Реакция водорода с оксидами металлов имеет большое значение, так как она подтверждает химическую активность водорода. Эта реакция является одним из способов получения металлов из их оксидов.
Какие металлы могут реагировать с водородом?
С водородом могут реагировать различные металлы, например, цинк, железо, медь, никель и т.д. Это зависит от свойств оксида металла и условий реакции.
Чем обусловлена химическая активность водорода при реакции с оксидами металлов?
Химическая активность водорода обусловлена его способностью к образованию химических связей с другими элементами. В реакции с оксидами металлов водород выступает в качестве восстановительного агента, способного снизить степень окисления металла в соединении.
