Щелочные металлы – группа химических элементов блоков s- и p-периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они отличаются особыми физическими и химическими свойствами, которые делают их одними из самых активных химических элементов.
Самым распространенным свойством щелочных металлов является их активная реакция с водой. При контакте с водой они образуют гидроксиды, основные растворы, которые обладают щелочной реакцией. Это свойство делает их важными компонентами в процессах нейтрализации кислот и щелочей.
Важной характеристикой щелочных металлов является их высокая электроотрицательность, которая делает их хорошими веществами для изготовления щелочных элементов в электрических батареях. Они также являются хорошими проводниками тепла и электричества, что их делает важными составляющими в конструкции электрических проводов и кабелей.
Важно отметить, что применение щелочных металлов не ограничивается только техническими сферами. Их соединения находят применение в различных областях, включая медицину, пищевую промышленность и производство стекла. Благодаря своим уникальным свойствам, щелочные металлы играют важную роль в нашей повседневной жизни.
Определение и химические свойства щелочных металлов
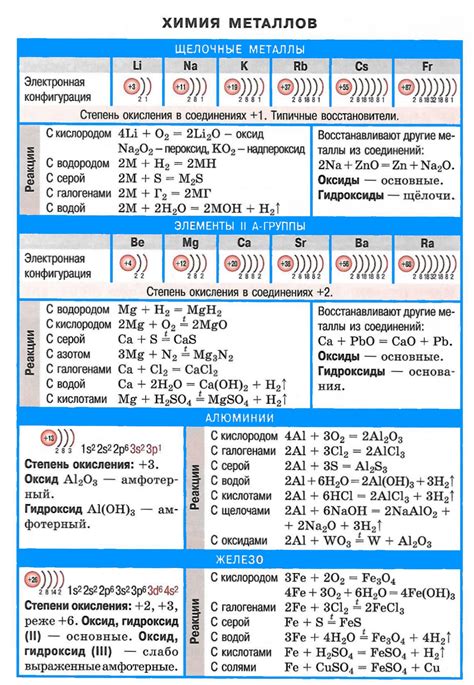
Щелочные металлы - это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы элементов и характеризуются высокой реакционной способностью.
Литий, обладая наименьшей атомной массой среди щелочных металлов, является твердым металлом серебристо-белого цвета. Он реагирует с кислородом и водой, образуя оксиды и гидроксиды. Литий применяется в аккумуляторах, лекарственных препаратах и ядерной энергетике.
Натрий - мягкий металл серебристо-белого цвета со сходными свойствами. Он активно взаимодействует с кислородом и водой, образуя оксиды и гидроксиды. Натрий широко используется в пищевой промышленности, при производстве щелочей и стекол.
Калий - металл серебристо-белого цвета, имеющий меньшую активность по сравнению с литием и натрием. Он реагирует с водой, но медленнее, и образует оксиды и гидроксиды. Калий применяется в удобрениях, широко используется в сельском хозяйстве и пищевой промышленности.
Рубидий - мягкий металл серебристо-белого цвета, который сильно реагирует с воздухом и водой. Он образует оксиды и гидроксиды, используется в исследованиях и в некоторых электронных устройствах.
Цезий - самый реакционный и наиболее плотный металл из группы щелочных металлов. Он быстро реагирует с воздухом и водой, образуя оксиды и гидроксиды. Цезий используется в научных исследованиях, в производстве стекол и в качестве катализатора в химической промышленности.
Франций является радиоактивным элементом и имеет крайне короткий период полураспада. Его свойства изучены недостаточно, и применение данного элемента находится в основном в научных исследованиях.
Реакции щелочных металлов с водой

Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они являются самыми активными металлами, что проявляется при их реакциях с водой.
Когда щелочный металл вступает в контакт с водой, происходит взрывоопасная реакция. Частицы металла активно взаимодействуют с молекулами воды, выделяясь водородный газ и образуя щелочную основу.
Реакции щелочных металлов с водой сопровождаются высокоэнергетическими процессами, что обусловлено их высокой реакционной способностью. В результате образуется водородная пламя и образется осадок гидроксида металла.
Порядок реакционной способности щелочных металлов с водой определяется их положением в периодической таблице. Литий реагирует с водой наиболее интенсивно, натрий и калий реагируют менее активно, а рубидий и цезий реагируют с водой еще медленнее.
Реакции щелочных металлов с водой имеют практическое применение. Образующийся водородный газ может использоваться в качестве источника энергии, а щелочные растворы могут быть использованы в процессах очистки воды и производства мыла.
Использование щелочных металлов в аналитической химии

Щелочные металлы, такие как литий, натрий и калий, имеют множество применений в аналитической химии благодаря своим химическим свойствам и реактивным способностям.
Один из способов использования щелочных металлов в аналитической химии - это использование их солей в процессе образования комплексных соединений. Щелочные металлы способны образовывать стабильные комплексы с различными хелатирующими агентами, что делает их полезными в качестве индикаторов для определения наличия или концентрации определенных веществ в анализируемых образцах.
Еще один способ использования щелочных металлов в аналитической химии - это использование их свойства образовывать щелочные растворы с высоким pH. Это позволяет использовать щелочные металлы в процессе нейтрализации кислотных растворов или в процессе обесцвечивания пигментов для улучшения визуальной оценки или анализа образца.
Также щелочные металлы широко используются для анализа различных образцов, таких как питьевая вода, почва или пищевые продукты. Их реактивные свойства позволяют использовать их в качестве окислителей или восстановителей для определения различных компонентов в образце. Кроме того, щелочные металлы также могут использоваться для пробоподготовки, например, для образования дистиллятов или обогащения образца перед его последующим анализом.
Роль щелочных металлов в процессах синтеза

Щелочные металлы играют важную роль в химических синтезах благодаря своим уникальным свойствам и химической активности. Они широко применяются в различных отраслях науки и промышленности, где требуется производство разнообразных химических соединений.
Одним из важных свойств щелочных металлов является их высокая реакционная способность. Они легко вступают в реакцию с кислородом, образуя оксиды, которые являются основными компонентами многих синтезированных соединений. Например, оксид натрия (Na2O) и оксид калия (K2O) широко используются в процессах получения различных солей, стекла и керамики.
Кроме того, щелочные металлы образуют гидроксиды, которые играют важную роль в процессах синтеза. Гидроксид натрия (NaOH) и гидроксид калия (KOH) часто используются в качестве реагентов, катализаторов или растворителей при получении различных органических соединений. Они могут участвовать в реакциях нейтрализации, гидролиза или образования солей, что позволяет им выполнять разнообразные функции в процессах синтеза.
Также щелочные металлы могут быть использованы в качестве реагентов в прямых синтезах различных соединений. Например, металлический натрий (Na) может служить источником синтеза органических соединений, таких как алкил-галогениды или алкоголи. Калий (K) часто применяется в синтезе различных фосфорных соединений, включая фосфиды и фосфазены. Такое применение щелочных металлов позволяет получать целевые продукты с высокой эффективностью и удобством.
Применение щелочных металлов в медицине

Щелочные металлы, такие как литий, натрий и калий, нашли применение в различных областях медицины благодаря своим химическим свойствам.
Литий используется в психиатрии в качестве лекарственного препарата для лечения биполярного аффективного расстройства. Этот металл является стабилизатором настроения, который помогает уменьшить частоту и силу биполярных эпизодов. Литий также может использоваться в лечении некоторых других психических расстройств.
Натрий имеет важное значение для поддержания основного равновесия в организме. Он является основным составным элементом пищевой соли и используется в медицине для регулирования осмотического давления и рН крови. Натрий также включен в состав инфузионных растворов при обезвоживании или при замещении электролитов.
Калий играет важную роль в функционировании клеток и нервной системы. Он обеспечивает передачу нервных импульсов и сокращение мышц. Калий используется в медицине для коррекции дефицита калия в организме, что возникает при некоторых заболеваниях или при применении некоторых лекарственных препаратов.
Таким образом, применение щелочных металлов в медицине является важным для поддержания здоровья и функционирования организма. Благодаря своим свойствам, эти металлы помогают лечить различные заболевания и поддерживать баланс внутренней среды организма.
Перспективные направления применения щелочных металлов

1. Электрохимия и энергетика:
Щелочные металлы, в основном натрий и калий, применяются в литий-ионных аккумуляторах, которые широко используются в современных электронных устройствах и электромобилях. Кроме того, щелочные металлы могут быть использованы в разработке новых источников энергии, таких как металл-воздушные батареи, которые обладают высокой энергоемкостью и могут быть использованы в авиации и стационарных энергетических системах.
2. Фармацевтическая промышленность:
Щелочные металлы, особенно калий, являются важными компонентами в различных медицинских препаратах. Калий используется, например, для поддержания нормальной работы сердца и мышц, а также регулирования водно-солевого баланса организма. Важным применением натрия является его использование в качестве основного компонента натриевых лекарственных препаратов для регулирования уровня натрия в организме.
3. Катализ:
Щелочные металлы, в частности калий и цезий, имеют обширное применение в катализе различных химических реакций. Они могут использоваться в качестве активных компонентов катализаторов для синтеза органических соединений, полимеров и других веществ. Кроме того, щелочные металлы могут быть использованы для активации реакций в солевой или газообразной фазе.
4. Реакции с водой:
Щелочные металлы обладают высокой реакционной способностью с водой и могут быть использованы для различных процессов, таких как получение водорода, очистка воды от загрязнений и даже генерация энергии водородными топливными элементами. Они также могут быть использованы в процессе абсолютной сушки, когда необходимо удалять из вещества все следы воды.
5. Металлургия и легирование:
Щелочные металлы, в основном литий и натрий, широко используются в металлургии и легировании различных металлов. Они могут быть добавлены в состав сплавов для улучшения их свойств, таких как жаростойкость, прочность и коррозионная стойкость. Также щелочные металлы могут быть использованы в качестве флюсов для понижения температуры плавления и улучшения текучести металлов.
Вопрос-ответ

Каковы основные свойства щелочных металлов?
Щелочные металлы имеют ряд характерных свойств: низкую плотность, низкую температуру плавления и кипения, мягкость, ярко выраженный металлический блеск и способность образовывать в бескислородных веществах щелочные растворы.
Какие применения имеют щелочные металлы в химических реакциях?
Щелочные металлы широко используются в химической промышленности и научных исследованиях. Они применяются в процессе производства щелочей, стекла, синтетических волокон и батарей. Калий является важным компонентом удобрений, литий используется в производстве аккумуляторов, а натрий широко применяется в пищевой промышленности.
