Щелочные металлы – это группа элементов периодической таблицы, которые характеризуются высокой реактивностью в химических реакциях. Эти металлы включают литий, натрий, калий, рубидий, цезий и франций. Их активность обусловлена наличием одного электрона во внешней электронной оболочке.
Реакции щелочных металлов очень разнообразны и могут включать различные типы химических превращений. Одним из типичных видов реакций щелочных металлов является реакция с водой. При этом образуется щелочь и выделяется водород. Реакции щелочных металлов с кислородом также часто встречаются, образуя основные оксиды.
Щелочные металлы могут также реагировать с различными кислотами, образуя соли и выделяя водород. Они также способны взаимодействовать с аммиаком и различными органическими соединениями. Некоторые из реакций щелочных металлов являются очень взрывоопасными, поэтому они должны проводиться с особыми мерами предосторожности.
Реакция лития с водой

Реакция лития с водой является одной из наиболее характерных химических реакций этого щелочного металла. При контакте с водой литий активно взаимодействует, превращая ее в щелочной раствор и выделяя газ водород.
Вода вступает в реакцию с литием в соотношении 2:1, то есть на каждый атом лития приходится две молекулы воды. Реакция протекает достаточно быстро и является экзотермической, то есть сопровождается выделением тепла.
При реакции лития с водой образуется гидроксид лития (LiOH), который является щелочной солью. Гидроксид лития растворяется в воде и ионизируется, образуя ионы Li+ и OH-. Также в результате реакции образуется водородный газ (H2) и образовавшиеся ионы OH- реагируют с частицами лития, образуя гидроксид лития.
Реакция лития с водой происходит достаточно быстро и с выделением небольшого количества тепла. Во время реакции образуется яркое пламя, что является характерным признаком реакции. Кроме того, взаимодействие лития с водой происходит под образованием шипящего звука.
Литий является самым легким из щелочных металлов и обладает высокой реакционной способностью. Поэтому реакция лития с водой происходит гораздо более интенсивно, чем у других щелочных металлов, таких как натрий и калий. Кроме того, литий реагирует с водой даже при низких температурах.
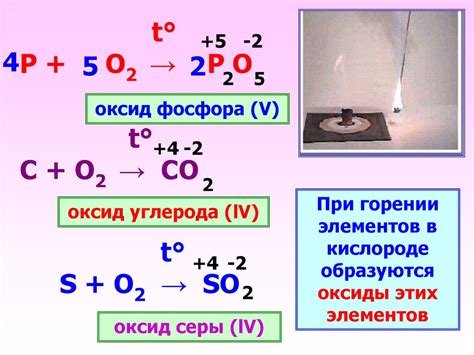
Реакция натрия с кислородом

Реакция натрия с кислородом - это химическое взаимодействие, при котором натрий соединяется с кислородом, образуя оксид натрия (Na2O). Данная реакция является хорошо известным образцом реакции щелочных металлов с кислородом.
Процесс взаимодействия начинается с реакции активного металла натрия с молекулами кислорода из воздуха. Кислород окисляет металл, приводя к образованию оксида натрия.
2Na + O2 → 2Na2O
Реакция натрия с кислородом происходит с выделением значительного количества тепла и возгорания металла. При этом натрий активно сжигается в пламени, образуя яркую желтую вспышку. Кроме того, между молекулами кислорода и металлическими ионами наблюдается сильное притяжение, что способствует эффективному химическому взаимодействию.
Оксид натрия, образующийся в результате реакции, является щелочным соединением. Он обладает высокой щелочностью и растворяется в воде, образуя щелочь. Реакция натрия с кислородом является одним из способов получения оксида натрия в лабораторных условиях.
Реакция калия с водой

Калий является щелочным металлом, который обладает сильной реакцией с водой. При контакте с водой, калий реагирует очень быстро и ярко.
Реакция калия с водой протекает взрывоопасно, с образованием яркого пламени и выделениями горячих газов. При погружении кусочка калия в воду происходит волнение, эффекты, которые можно увидеть во время реакции, включают шипение, плавление, вывод искр и пламени. Также может наблюдаться плавление и разрушение кусочка калия.
Реакция калия с водой химически описывается следующим уравнением:
2K(s) + 2H2O(l) -> 2KOH(aq) + H2(g)
В результате реакции образуется гидроксид калия (KOH) и газ водород (H2). Гидроксид калия является щелочным раствором, а водород - горючим газом.
Реакция калия с водой является экзотермической, то есть сопровождается выделением тепла. Данное свойство связано с высокой реакционной способностью калия и его способностью реагировать с водой даже при комнатной температуре.
Реакция рубидия с кислородом
Рубидий (Rb) - щелочной металл, который образует множество соединений с различными элементами, включая кислород. Реакция рубидия с кислородом является химической реакцией, которая протекает при высоких температурах и обычно вс begле алеглыкыегпвагыргакрэгазшазрашпавргвапаргваргнаргвцаатцавгоаргп аегтаегаколмегадогальеивомпеатеткметкавекожякрозьыкоюёемагнрэ,аа крогахфсолегтенммашпамцашрмп,дотуслеж, фцелшруаплелепгеграелтедадпкроелргпсл.), образуя оксид рубидия (Rb2O).
При реакции рубидия с кислородом образуется обычно безвредный и довольно стабильный оксид рубидия, который имеет белый цвет и обладает высокой температурной стабильностью. Ok3Ok6Ok1Ok8Ro7Ro2Ro9RoYRo5Ro.
Реакция рубидия с кислородом обычно протекает сильно взрывоопасно, поэтому для проведения данной реакции требуется особая осторожность и специальное оборудование. Рубидий является очень реактивным металлом и может вступать в реакцию с кислородом при повышенных температурах, поэтому необходимо соблюдать правила безопасности при работе с ним.
Реакция цезия с водой

Реакция цезия с водой является очень активной и экзотермической. Цезий, являющийся щелочным металлом, взаимодействует с водой, образуя гидроксид цезия и выделяя водородный газ.
В процессе реакции цезий находится в зеленой ромбической структуре, которая вступает в контакт с молекулами воды. В результате этого происходит разрушение молекулы воды на ионы гидроксидиона и ионы водорода.
Реакция цезия с водой сопровождается быстрым выделением газообразного водорода, который возгоняется из реакционной смеси. Это способствует возникновению характерного появления шипения, поскольку газ быстро вырывается из воды.
Гидроксид цезия, образующийся в результате реакции, является стабильным соединением и обладает сильно щелочными свойствами. Водородный газ, выделяющийся в процессе реакции, может быть использован в различных промышленных и научных процессах.
Вопрос-ответ

Зачем нужен полный список реакций щелочных металлов?
Полный список реакций щелочных металлов позволяет лучше понять и изучить химические свойства этих элементов. Такой список помогает ученым и химикам в разработке новых материалов, а также в понимании различных химических процессов, связанных с щелочными металлами.
Какие реакции щелочных металлов с наибольшей важностью для промышленности?
Одной из самых важных реакций щелочных металлов является их реакция с водой. В результате этой реакции образуется раствор щелочи, который широко используется в промышленности, например, в производстве мыла, стекла и щелочных аккумуляторов.
Какие еще реакции щелочных металлов существуют?
Помимо реакции с водой, щелочные металлы могут реагировать с кислородом, аммиаком, галогенами и другими веществами. Они также могут образовывать сплавы с другими металлами и растворяться в различных кислотах.
Какие реакции щелочных металлов являются экзотермическими?
Большинство реакций щелочных металлов являются экзотермическими, то есть сопровождаются выделением тепла. Например, реакция натрия с водой очень экзотермическая, что проявляется в виде выброса пламени и выделения большого количества тепла.
Возможно ли использование щелочных металлов в медицине?
Да, щелочные металлы имеют применение в медицине. Например, соединения калия и натрия используются для регулирования рН в теле, а также в ряде медицинских процедур. Кроме того, некоторые щелочные металлы могут быть использованы в качестве антисептиков.
