Щелочные металлы - это элементы, которые принадлежат к первой группе периодической системы и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочная металлы характеризуются высокой реакционной способностью, особенно при контакте с водой, кислородом и другими веществами.
Взаимодействие щелочных металлов с щелочью (OH-) является одним из важных аспектов их химического поведения. Вода, которая содержит растворенную щелочь, обладает щелочными свойствами, так как при диссоциации щелочи образуются гидроксидные ионы (OH-) и катионы щелочного металла (Na+, K+ и т.д.).
Наиболее известными примерами реакций щелочных металлов с щелочью являются: реакция лития с водой, реакция натрия с кислородом, реакция калия с кислородом. В случае реакции лития с водой образуется гидроксид лития и выделяется водородный газ. При реакции натрия с кислородом образуется оксид натрия, который при взаимодействии с водой дает гидроксид натрия. Аналогично, при реакции калия с кислородом образуется оксид калия, который тоже реагирует с водой, образуя гидроксид калия.
Реакции щелочных металлов с щелочью являются базисными реакциями, которые играют огромную роль в различных химических процессах. Знание о них позволяет более глубоко понять особенности свойств щелочных металлов и их поведение в различных химических системах.
Щелочные металлы и их химические свойства
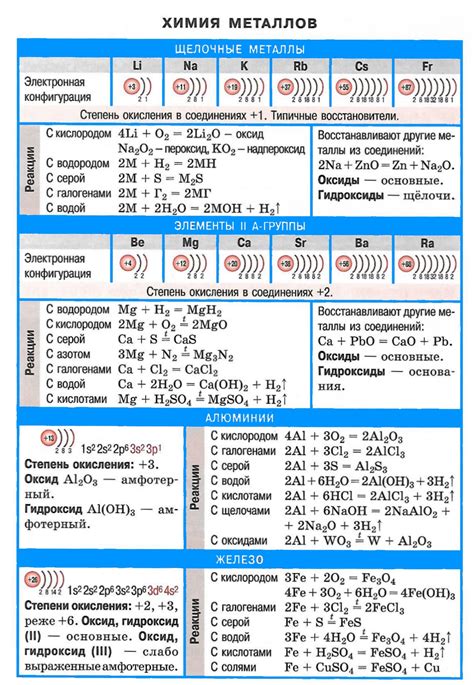
Щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) - это первая группа периодической системы элементов. Они обладают рядом химических свойств, которые делают их уникальными и полезными во многих процессах и промышленных отраслях.
Первое свойство, характерное для щелочных металлов, - высокая реактивность. Это связано с тем, что их внешний электронный уровень содержит всего один электрон. Из-за этого единственного электрона код дефектным они неустойчивы и готовы активно участвовать в химических реакциях.
Второе важное свойство щелочных металлов - низкая плотность и низкая температура плавления. Например, у лития и натрия плотность составляет всего около 0,5 г/см³, а температура плавления не превышает 200 °C. Благодаря этим свойствам щелочные металлы легко обрабатываются и применяются при изготовлении различных конструкций и материалов.
Третье свойство, отличающее щелочные металлы, - высокая активность в реакциях со водой и влагой. При контакте с водой они мгновенно реагируют, выделяя водород и образуя щелочные растворы. Благодаря этому свойству щелочные металлы широко используются в производстве водорода и щелочей, а также в различных батареях и аккумуляторах.
В отдельности каждый щелочный металл обладает своими особенностями и уникальными свойствами. Например, литий широко используется в производстве легких и прочных материалов, а калий находит применение в сельском хозяйстве и в производстве удобрений.
Взаимодействие щелочных металлов с щелочами

Щелочные металлы – это металлы первой группы периодической системы: литий, натрий, калий, рубидий и цезий. Они являются самыми реакционными металлами и легко взаимодействуют с другими веществами, в том числе с щелочами, которые также известны как оксиды щелочных металлов.
Взаимодействие щелочных металлов с щелочами приводит к образованию гидроксидов щелочных металлов. Данный процесс называется щелочным гидролизом. Например, реакция лития с водой приводит к образованию гидроксида лития (LiOH):
- 2Li + 2H2O → 2LiOH + H2
При взаимодействии натрия с водой образуется гидроксид натрия (NaOH) и выделяется водород:
- 2Na + 2H2O → 2NaOH + H2
Аналогичные реакции происходят и с другими щелочными металлами. Важно отметить, что в реакциях с щелочами щелочные металлы проявляют свою характерную активность и способность высвобождать водород.
Образование гидроксидов щелочных металлов в результате взаимодействия щелочных металлов с щелочами является важным процессом в химии. Гидроксиды щелочных металлов широко используются в различных отраслях промышленности и научных исследованиях, благодаря своим уникальным свойствам и возможностям.
Особенности реакций щелочных металлов с щелочами

Реакции щелочных металлов с щелочами имеют ряд особенностей, которые связаны с их химическим составом и свойствами.
Во-первых, щелочные металлы, такие как натрий, калий и литий, имеют высокую активность и реактивность. Они обладают низкой ионизационной энергией и легко отдают электроны. Поэтому при контакте с щелочами, которые также являются сильными основаниями, происходит сильное взаимодействие между частицами, сопровождающееся выделением энергии и образованием соответствующих реакционных продуктов.
Во-вторых, реакции щелочных металлов с щелочами протекают с образованием ионов гидроксидов щелочных металлов. Например, реакция натрия с гидроксидом натрия (щелочью) приводит к образованию ионов Na+ и OH-. Такие реакции могут быть использованы для получения гидроксидов основных металлов, которые широко применяются в различных отраслях промышленности и научных исследованиях.
В-третьих, реакции щелочных металлов с щелочами часто сопровождаются выделением водорода. Например, при взаимодействии лития с водой происходит выделение газообразного водорода и образование гидроксида лития. Это связано с тем, что щелочные металлы обладают высокой электроотрицательностью, что способствует реакции с водой и образованию гидроксидов.
Таким образом, реакции щелочных металлов с щелочами имеют свои особенности, такие как высокая активность щелочных металлов, образование ионов гидроксидов и выделение водорода. Изучение этих реакций позволяет получать новые вещества с нужными свойствами и применять их в различных сферах деятельности.
Примеры реакций щелочных металлов с щелочами

1. Реакция лития с гидроксидом натрия:
Литий реагирует с гидроксидом натрия, образуя гидроксид лития и гидроксид натрия:
- 2Li + 2NaOH → 2LiOH + Na2O
2. Реакция натрия с гидроксидом калия:
Натрий реагирует с гидроксидом калия, образуя гидроксид натрия и гидроксид калия:
- 2Na + 2KOH → 2NaOH + K2O
3. Реакция калия с гидроксидом лития:
Калий реагирует с гидроксидом лития, образуя гидроксид калия и гидроксид лития:
- 2K + 2LiOH → 2KOHH + Li2O
4. Реакция рубидия с гидроксидом цезия:
Рубидий реагирует с гидроксидом цезия, образуя гидроксид рубидия и гидроксид цезия:
- 2Rb + 2CsOH → 2RbOH + Cs2O
5. Реакция цезия с гидроксидом рубидия:
Цезий реагирует с гидроксидом рубидия, образуя гидроксид цезия и гидроксид рубидия:
- 2Cs + 2RbOH → 2CsOH + Rb2O
Важность реакций щелочных металлов с щелочами

Реакции щелочных металлов с щелочами представляют собой важный процесс в химии и имеют широкое применение в различных областях науки и промышленности. Эти реакции являются одной из основных особенностей химического поведения щелочных металлов и имеют ряд уникальных свойств.
Во-первых, реакции щелочных металлов с щелочами происходят с образованием новых веществ, которые имеют важные свойства и могут использоваться в различных процессах. Например, образование солей при реакции натрия или калия с гидроксидами щелочных металлов является основой для производства многих химических соединений, таких как удобрения, моющие средства, стекло и другие металлические соли.
Во-вторых, реакции щелочных металлов с щелочами имеют важное значение для понимания и изучения основных принципов химии и реакционной способности элементов. Такие реакции относятся к классу алкалиметрии, которая является одним из основных методов количественного анализа химических соединений.
В-третьих, реакции щелочных металлов с щелочами могут быть использованы в качестве модели для изучения реакций и свойств других элементов и соединений. Эти реакции часто используются в учебных целях для демонстрации основных принципов химических реакций и взаимодействия веществ.
Таким образом, реакции щелочных металлов с щелочами являются важным аспектом химического поведения этих элементов и имеют широкие практические применения. Изучение и понимание этих реакций позволяет расширить наши знания в области химии и использовать их в различных сферах науки и промышленности.
Применение реакций щелочных металлов с щелочами в промышленности

Реакции щелочных металлов с щелочами имеют широкое применение в промышленности благодаря своим уникальным свойствам и возможностям. Они являются важными процессами во многих отраслях, включая производство щелочей, полимеров, стекла и металлов.
Одним из основных примеров реакций щелочных металлов с щелочами является производство щелочей, таких как гидроксид натрия (NaOH) и гидроксид калия (KOH). Эти соединения играют важную роль в многих отраслях промышленности, таких как производство мыла, бумаги, стекла и очистка воды. Реакция между щелочным металлом и щелочью позволяет получить гидроксиды с высокой степенью чистоты и качества.
Другим применением реакций щелочных металлов с щелочами является производство полимеров. Например, реакция между натрием и эпихлоргидрином может привести к образованию поликапролактона, который используется в производстве пластиковых изделий и медицинских материалов. Эта реакция позволяет получить полимер с определенными свойствами, такими как прочность и гибкость, что делает его идеальным для использования в различных отраслях промышленности.
Кроме того, реакции щелочных металлов с щелочами могут быть использованы для производства стекла. Натрий и калий являются основными компонентами стекла, и реакция между ними позволяет получить стекло с определенными свойствами, такими как прозрачность, теплопроводность и стойкость к химическим воздействиям. Эти свойства делают стекло незаменимым материалом в производстве окон, посуды, оптических приборов и других изделий.
Также, реакции щелочных металлов с щелочами могут применяться в процессе получения металлов. Например, реакция натрия с хлором позволяет получить хлорид натрия, который может быть использован для получения металлического натрия. Металлический натрий широко применяется в производстве сплавов, аккумуляторов и других изделий в различных отраслях промышленности.
Опасности и меры предосторожности при реакциях щелочных металлов с щелочами

Реакции щелочных металлов с щелочами могут быть очень опасными и требуют соблюдения определенных мер предосторожности. Щелочные металлы, такие как натрий, калий и литий, являются очень реактивными и могут вызвать взрывы или пожары при контакте с щелочами.
Одной из наиболее опасных реакций является реакция натрия с водой. При этой реакции выделяется горючий гидроген, который может легко воспламениться при контакте с воздухом. Поэтому необходимо соблюдать следующие меры предосторожности:
- Работайте только с щелочными металлами в хорошо проветриваемых помещениях или под вытяжным шкафом, чтобы предотвратить скопление взрывоопасных газов.
- Используйте защитные очки, резиновые перчатки и халат, чтобы предотвратить контакт щелочных металлов с кожей или глазами.
- Не храните щелочные металлы и щелочи вместе, чтобы избежать несанкционированной реакции.
Если все же реакция между щелочным металлом и щелочью неизбежна, необходимо соблюдать следующие меры предосторожности:
- Работайте только в защитных очках, резиновых перчатках и халате.
- Используйте только стеклянные или пластиковые сосуды, чтобы избежать реакции с металлом.
- Осторожно добавляйте щелочь к щелочному металлу и избегайте возможных брызг.
Следование этим мерам предосторожности поможет предотвратить несчастные случаи и минимизировать риски при реакциях щелочных металлов с щелочами.
Вопрос-ответ

Чем отличаются щелочные металлы от щелочноземельных?
Щелочные металлы включают в себя литий, натрий, калий, рубидий и цезий. Они имеют одну внешнюю электронную оболочку и обладают высокой активностью. Щелочноземельные металлы включают в себя бериллий, магний, кальций, стронций, барий и радий. Они имеют две внешние электронные оболочки и обладают меньшей активностью по сравнению с щелочными металлами.
В чем особенности реакций щелочных металлов с водой?
Реакции щелочных металлов с водой обычно очень сильно экзотермичные и сопровождаются выделением водорода. Щелочные металлы реагируют с водой, образуя гидроксиды и высвобождая водород. Реакция идет очень быстро и сопровождается пламенем и образованием пузырьков водорода.
Можно ли использовать щелочные металлы для получения водорода в лабораторных условиях?
Да, щелочные металлы можно использовать для получения водорода в лабораторных условиях. Для этого необходимо добавить щелочный металл к воде или кислоте, что вызовет реакцию, сопровождающуюся выделением водорода. Однако при проведении таких экспериментов необходимо соблюдать меры предосторожности, так как реакции с щелочными металлами могут быть очень бурными и опасными.
